










高中化学人教版 (2019)必修 第一册第二章 海水中的重要元素——钠和氯第一节 钠及其化合物示范课课件ppt
展开1.通过实验认识Na2CO3、NaHCO3的性质,培养科学探究意识。2.了解焰色试验的操作与应用。
核心素养 发展目标
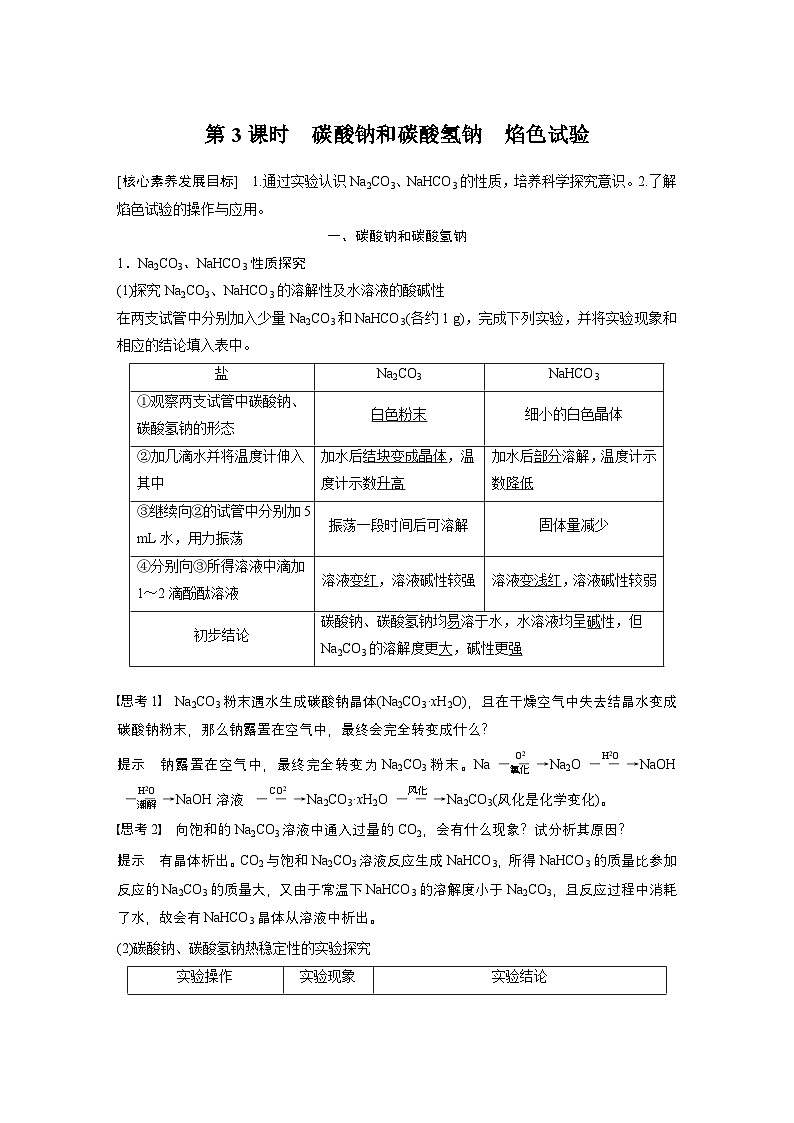
1.Na2CO3、NaHCO3性质探究(1)探究Na2CO3、NaHCO3的溶解性及水溶液的酸碱性在两支试管中分别加入少量Na2CO3和NaHCO3(各约1 g),完成下列实验,并将实验现象和相应的结论填入表中。
【思考1】 Na2CO3粉末遇水生成碳酸钠晶体(Na2CO3·xH2O),且在干燥空气中失去结晶水变成碳酸钠粉末,那么钠露置在空气中,最终会完全转变成什么?
【思考2】 向饱和的Na2CO3溶液中通入过量的CO2,会有什么现象?试分析其原因?
提示 有晶体析出。CO2与饱和Na2CO3溶液反应生成NaHCO3,所得NaHCO3的质量比参加反应的Na2CO3的质量大,又由于常温下NaHCO3的溶解度小于Na2CO3,且反应过程中消耗了水,故会有NaHCO3晶体从溶液中析出。
(2)碳酸钠、碳酸氢钠热稳定性的实验探究
Na2CO3很稳定,受热不易发生
NaHCO3不稳定,受热容易分解
Na2CO3+CO2↑+H2O
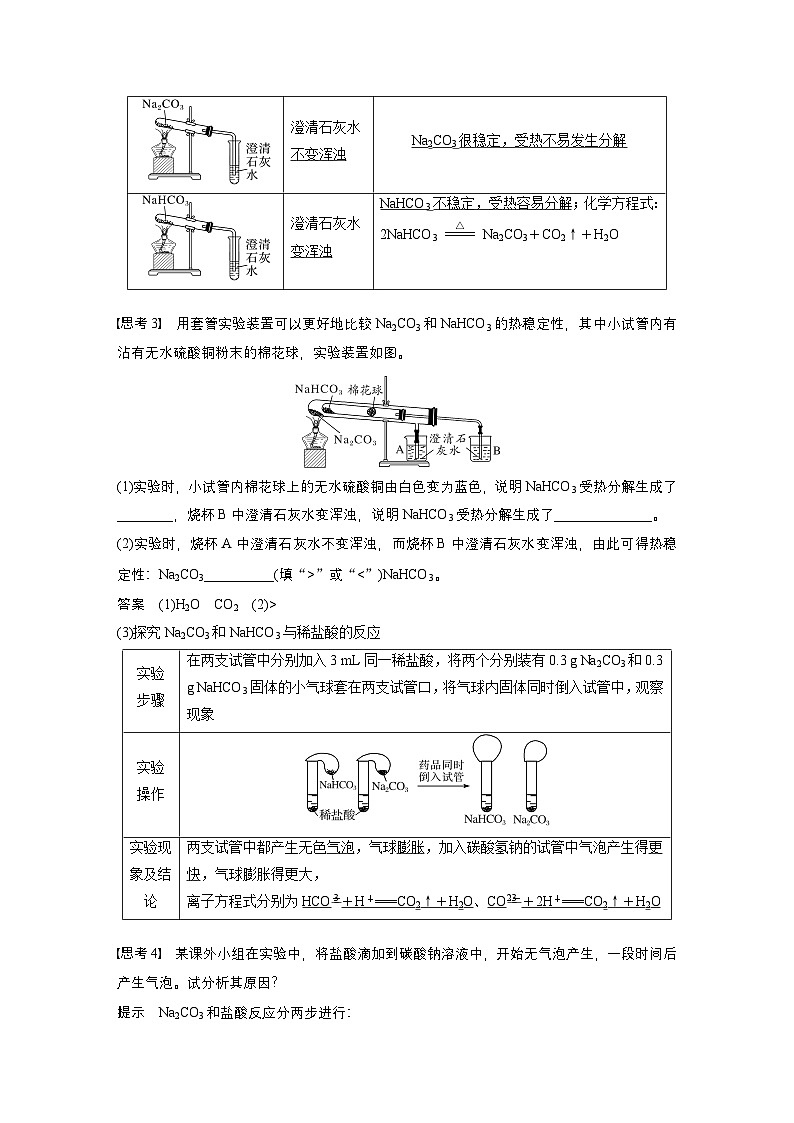
【思考3】 用套管实验装置可以更好地比较Na2CO3和NaHCO3的热稳定性,其中小试管内有沾有无水硫酸铜粉末的棉花球,实验装置如图。
(1)实验时,小试管内棉花球上的无水硫酸铜由白色变为蓝色,说明NaHCO3受热分解生成了______,烧杯B中澄清石灰水变浑浊,说明NaHCO3受热分解生成了______。(2)实验时,烧杯A中澄清石灰水不变浑浊,而烧杯B中澄清石灰水变浑浊,由此可得热稳定性:Na2CO3____(填“>”或“<”)NaHCO3。
(3)探究Na2CO3和NaHCO3与稀盐酸的反应
【思考4】 某课外小组在实验中,将盐酸滴加到碳酸钠溶液中,开始无气泡产生,一段时间后产生气泡。试分析其原因?
提示 Na2CO3和盐酸反应分两步进行:
故开始无明显现象,后来产生气泡。
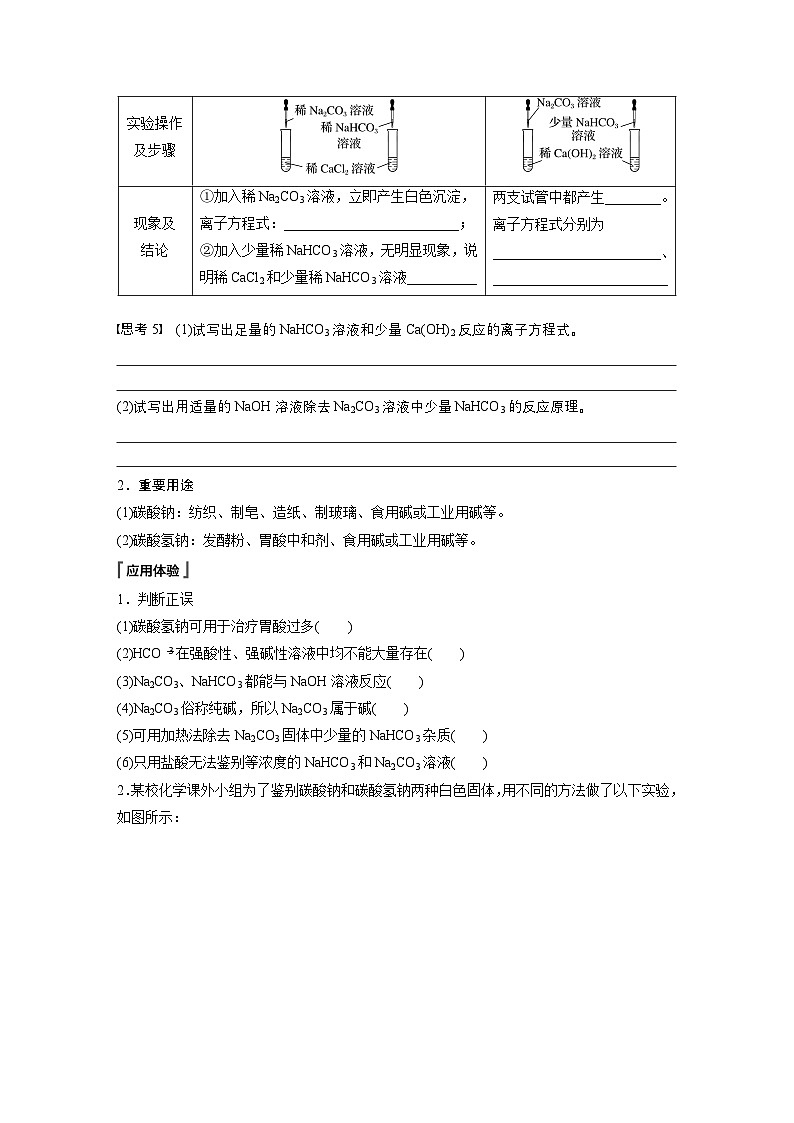
(4)探究Na2CO3、NaHCO3和盐(CaCl2)及碱[Ca(OH)2]的反应
+OH-===CaCO3↓+H2O
【思考5】 (1)试写出足量的NaHCO3溶液和少量Ca(OH)2反应的离子方程式。
(2)试写出用适量的NaOH溶液除去Na2CO3溶液中少量NaHCO3的反应原理。
2.重要用途(1)碳酸钠:纺织、制皂、造纸、制玻璃、食用碱或工业用碱等。(2)碳酸氢钠:发酵粉、胃酸中和剂、食用碱或工业用碱等。
1.判断正误(1)碳酸氢钠可用于治疗胃酸过多(2) 在强酸性、强碱性溶液中均不能大量存在(3)Na2CO3、NaHCO3都能与NaOH溶液反应(4)Na2CO3俗称纯碱,所以Na2CO3属于碱(5)可用加热法除去Na2CO3固体中少量的NaHCO3杂质(6)只用盐酸无法鉴别等浓度的NaHCO3和Na2CO3溶液
2.某校化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下实验,如图所示:
(1)只根据图Ⅰ所示实验,不能够达到实验目的的原因是_______________________________________________________________________________________________。
还是NaHCO3,均可以与盐酸反应产生CO2,均可使澄清石灰水变浑浊,故达不到鉴别目的
(2)图Ⅱ、Ⅲ所示实验均能鉴别这两种物质,其反应的化学方程式为__________________________________________________________________。(3)若用实验Ⅱ验证碳酸钠和碳酸氢钠的热稳定性,则试管B中装入的固体最好是________(填化学式)。
Na2CO3和NaHCO3的三种鉴别方法
1.定义利用很多 或它们的 在灼烧时都会使火焰呈现出特征颜色判断试样所含的金属元素,化学上把这样的 分析操作称为焰色试验。焰色试验是元素的 性质。
3.一些金属元素的焰色
【思考1】 为什么用盐酸洗涤铂丝而不用硫酸洗涤铂丝?为什么用铂丝或铁丝等蘸取试剂做焰色试验,而不采用铜丝?
提示 盐酸沸点比硫酸低,加热时易挥发无残留。铂丝或铁丝做焰色试验时没有颜色,而铜在灼烧时有绿色的焰色。
【思考2】 利用焰色试验检验钾元素时,为什么要透过蓝色钴玻璃进行观察?
提示 因为含有钾元素的物质中往往会混有少量的钠元素,灼烧时,钠元素的黄色光会掩盖钾元素的紫色光,透过蓝色钴玻璃可以滤去黄色光,便于观察到钾元素的紫色光。
4.应用(1)检验 的存在。(2)利用焰色试验制节日烟花。
1.判断正误(1)焰色试验是物质在灼烧时发生了化学反应而呈现不同的焰色(2)焰色试验的铂丝可用稀硫酸洗净(3)可利用焰色试验来鉴别Na2CO3溶液和K2CO3溶液(4)用洁净的铂丝蘸取某溶液在火焰上灼烧,火焰呈紫色(透过蓝色钴玻璃),则该溶液一定含有钾盐
2.用焰色试验检验K+时的操作有:①蘸取待测液;②置于酒精灯火焰上灼烧;③透过蓝色钴玻璃观察;④用稀盐酸洗净铂丝。正确的操作顺序为A.①②③④ B.④②①②③C.④①② D.①③②④
1.(2023·桂林高一检测)在做面包、蛋糕等面食点心时需要加入一定量的发酵粉,下列物质是发酵粉的主要成分之一的是A.氯化钠 B.碳酸钠C.硫酸钠 D.碳酸氢钠
2.(2022·长沙高一检测)为除去括号内的杂质,所选用的试剂或方法错误的是A.CO2气体(HCl),饱和NaHCO3溶液B.Na2CO3固体(NaHCO3),加热至不再产生气体C.NaHCO3溶液(Na2CO3),通入过量的CO2后微热D.Na2CO3溶液(Na2SO4),加入适量Ba(OH)2溶液,过滤
3.(2022·金华第八中学高一检测)用洁净的铂丝蘸取某无色溶液,放在无色火焰上灼烧,火焰的颜色呈黄色,下列说法错误的是A.该溶液中可能含有钠离子,一定没有钾离子B.该溶液中一定含有钠离子C.该溶液中一定没有铜离子D.该溶液中可能含有钾离子
4.(2022·邯郸高一月考)CO2、Na2CO3、NaHCO3三者的转化关系如图所示,下列说法错误的是A.①转化时所加试剂可以是稀硫酸B.向NaOH溶液中通入少量CO2可实现②转化C.⑤转化时溶液中一定出现沉淀D.⑥的转化条件可以是加热
5.碳酸钠和碳酸氢钠是生活中常见的物质。请回答下列问题:(1)碳酸氢钠的化学式是________,俗称________,其水溶液显_____(填“酸”“碱”或“中”)性。(2)碳酸氢钠可治疗胃酸(0.2%~0.4%的盐酸)过多,反应的离子方程式为_________________________。等质量的碳酸钠和碳酸氢钠与足量盐酸反应时生成CO2的量:前者_____(填“>”“<”或“=”)后者。(3)除去碳酸钠固体中碳酸氢钠的反应的化学方程式为___________________________________。
Na2CO3+H2O+CO2↑
题组一 Na2CO3与NaHCO3的性质、用途1.下列各组物质中,其学名、俗名及化学式不相符合的是A.碳酸钠、纯碱、Na2CO3 B.碳酸氢钠、小苏打、NaHCO3C.氢氧化钠、火碱、NaOH D.碳酸钙、生石灰、CaCO3
2.(2022·温州高一期中)下列叙述不正确的是A.NaHCO3的热稳定性弱于Na2CO3B.向Na2CO3固体中加几滴水,Na2CO3凝结成块并伴随吸热现象C.Na、Na2O、NaOH长期放置在空气中,最终都变成Na2CO3D.保持温度不变,向Na2CO3饱和溶液中通入过量的CO2,有NaHCO3晶 体析出
3.下列离子方程式书写正确的是
4.(2023·扬州高一检测)按如图装置持续通入X气体,并在管口P处点燃,实验结果使澄清石灰水变浑浊。则X、Y可以是A.H2、NaHCO3 B.CO、Na2CO3C.CO、Na2O2 D.H2、Fe2O3
题组二 Na2CO3与NaHCO3性质比较及实验探究5.某课外小组为了鉴别Na2CO3和NaHCO3两种白色固体,设计了如图几种实验方法。下列说法不正确的是A.装置Ⅰ中的Na2CO3和NaHCO3 均能与盐酸反应,产生气体速 率快的是NaHCO3B.当稀盐酸足量时,装置Ⅰ中气球鼓起体积较小的是NaHCO3C.加热装置Ⅱ,使澄清石灰水变浑浊一侧的白色固体是NaHCO3D.装置Ⅲ也可以鉴别Na2CO3和NaHCO3
6.(2022·吉林高一期中)下列有关Na2CO3与NaHCO3叙述中错误的是A.相同状况下,等质量的NaHCO3和Na2CO3分别与足量盐酸反应, Na2CO3产生的CO2气体体积小于NaHCO3B.反应放出等量的CO2所消耗的酸:NaHCO3>Na2CO3C.选用NaHCO3而不选择Na2CO3治疗胃酸过多,其原因为Na2CO3的碱性 太强D.Na2CO3溶液中混有少量NaHCO3杂质,可加入适量NaOH除去
题组三 焰色试验7.(2022·宁海县校级期末)节日燃放的烟花利用了“焰色试验”的原理。下列说法正确的是A.焰色试验属于化学变化B.NaCl与Na2CO3灼烧时火焰颜色相同C.某样品的焰色为黄色,则该样品仅含有钠元素D.焰色试验时金属丝应用硫酸清洗并在外焰上灼烧至没有颜色,再蘸取 样品灼烧
8.(2022·昆明高一检测)焰色试验过程中铂丝的清洗和灼烧与钾的焰色的观察两项操作如图所示:下列叙述不正确的是A.每次实验中都要先将铂丝灼烧至与原来火焰颜色相同,再蘸取被检验 的物质B.钾的焰色要透过蓝色钴玻璃观察C.实验时最好选择本身颜色较深的火焰D.没有铂丝可用光洁无锈的铁丝代替进行实验
9.(2023·济南调研)下列有关焰色试验操作的描述正确的是A.在观察焰色时均要透过蓝色钴玻璃,以便排除钠元素的黄光的干扰B.取一根洁净的细铂丝,放在酒精灯上灼烧至与火焰颜色相同,再蘸取 少量NaCl溶液,进行焰色试验C.铂丝在做完氯化钠溶液的焰色试验后,用稀硫酸洗净,再蘸取少量的 K2SO4溶液,重复以上实验D.灼烧时,所有金属或金属阳离子均有焰色
10.(2022·南昌高一月考)取16.8 g NaHCO3固体,加热一段时间,将剩余固体分成四等份,分别取四份固体进行实验。下列能够说明NaHCO3固体已完全分解的是A.加水溶解后滴加酚酞,溶液变红B.加水溶解后滴加澄清石灰水,有白色沉淀产生C.称量固体,继续加热,冷却后再次称量所得固体,质量不变D.加入足量的盐酸,充分反应后,将溶液蒸干,所得固体质量为11.7 g
11.(2022·杭州期末)过碳酸钠(2Na2CO3·3H2O2)又称固体过氧化氢,能杀灭病毒,是一种良好的消毒剂,也可作为漂白剂、去污剂。下列说法不正确的是A.过碳酸钠具有强氧化性B.可预测过碳酸钠不稳定,受热易分解C.含有二氧化锰或高温条件不影响过碳酸钠的保存D.向过碳酸钠溶于水后的溶液中滴入澄清石灰水,会出现白色沉淀
12.(2023·北京延庆高一期末)下列实验方案中,不能测定Na2CO3和NaHCO3混合物中Na2CO3的质量分数的是A.取a g混合物充分加热,减重b gB.取a g混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b g固体C.取a g混合物与足量氢氧化钠充分反应,加热、蒸干、灼烧,得b g固体D.取a g混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干,得b g 固体
13.(2022·广西贺州高一月考)Na2CO3、NaHCO3是生活中常见的盐,某实验小组通过以下实验探究这两种物质的性质。(1)称取两种固体各1 g分别放入两支试管中,再各加入5 mL水,充分振荡,并恢复至室温。发现Na2CO3完全溶解,而NaHCO3有剩余。由此得出结论:在相同温度下,______________________________。
碳酸钠的溶解度比碳酸氢钠的大
(2)某学生设计如图所示装置进行NaHCO3的分解实验,并证实产物中有CO2产生。①试管中发生反应的化学方程式为____________________________________。
②指出该学生设计的装置图的错误之处:________________________________________________。
试管口没有略向下倾斜,伸入试管的导管伸得太长
(3)测定Na2CO3样品(含氯化钠杂质)中Na2CO3的质量分数:①称取m g样品放入烧杯内加水溶解。②加入过量的氯化钙溶液充分反应,反应的化学方程式为_________________________________。③过滤、洗涤、干燥,称量沉淀的质量为n g。则样品中Na2CO3的质量分数为_______。
CaCl2+Na2CO3
===CaCO3↓+2NaCl
14.X、Y、Z、W四种化合物均由1~18号元素组成,其中X含有四种元素,X、Y、Z均含钠元素,W为无色无味气体。这四种化合物具有下列转化关系(部分反应物、产物及反应条件已略去)。请回答下列问题:
(1)X生成Z的化学方程式是__________________________________。
(2)X含有的四种元素之间(二种、三种或四种)可组成多种化合物,选用其中某些化合物,利用如图装置(夹持固定装置已略去)进行实验,装置Ⅲ中产生白色沉淀,装置Ⅴ中可收集到一种无色气体。
①装置Ⅱ中物质的化学式是________。
②用X含有的四种元素中的两种组成的某化合物,在催化剂存在下制备并收集纯净干燥的装置Ⅴ中气体,所需仪器装置是____________(从上图中选择必要装置,填写编号)。
(3)为测定X和Z混合物中Z的质量分数,某课外小组取a g混合物充分加热,质量减少b g,则混合物中Z的质量分数是_______________(用含a、b的代数式表示)。
15.膨松剂反应生成气体的量是检验膨松剂品质的一项重要指标。某膨松剂中起膨松剂作用的物质为碳酸氢钠和碳酸氢铵,已知碳酸氢铵加热产生CO2、NH3和H2O。(1)某学校兴趣小组为研究该膨松剂在加热情况下发生的反应和放出的气体的量,设计了以下实验。实验Ⅰ:将一定质量的固体样品置于试管中,用酒精灯加热片刻,在试管口立即可以闻到刺激性气味;加热足够长时间后,试管中仍有固体残留。
①结合以上实验现象,请写出加热时试管中所发生反应的化学方程式:______________________________________________________________________。
②运用相关计算,说明在碳酸氢钠中添加一定量碳酸氢铵的好处:__________________________________。
等质量的NH4HCO3可以产生更多CO2
实验Ⅱ:测定二氧化碳的质量按如图所示连接装置(气密性良好,各装置中的试剂皆为足量)。
[资料]a.浓硫酸常用于吸收水蒸气和氨气。b.碱石灰是固体氢氧化钠和氧化钙的混合物,不与氨气反应。
将一定质量的膨松剂样品装入装置B中,测定实验前后装置______(填装置对应的字母)的质量,其质量差即为样品产生的二氧化碳的质量。加热前,先对已连接好的装置A、B和C通入一段时间的空气,再连接上装置D、E;停止加热后,应继续通入一段时间的空气。这样做的目的是___________________________________________。
排尽装置中的CO2,将产生的CO2全部通入D中
实验Ⅲ:测定氨气的质量调整上图装置的连接顺序为________。另取相同质量的膨松剂装入装置B中,测定实验前后装置C的质量,其质量差即为样品产生的氨气的质量。
(2)实验Ⅱ中,若没有装置E,可能会造成测定结果________(填“偏大”“偏小”或“不变”)。
人教版 (2019)必修 第一册第一节 钠及其化合物教学ppt课件: 这是一份人教版 (2019)必修 第一册第一节 钠及其化合物教学ppt课件,共37页。PPT课件主要包含了素养要求,碳酸钠和碳酸氢钠,焰色试验,课堂检测等内容,欢迎下载使用。
人教版 (2019)必修 第一册第一节 钠及其化合物教学演示课件ppt: 这是一份人教版 (2019)必修 第一册第一节 钠及其化合物教学演示课件ppt,共23页。PPT课件主要包含了夯基提能·一遍过,浅红色,制玻璃,焙制糕点,答案B,答案D,小苏打,焰色试验等内容,欢迎下载使用。
化学必修 第一册第一节 钠及其化合物课文配套ppt课件: 这是一份化学必修 第一册第一节 钠及其化合物课文配套ppt课件,共44页。PPT课件主要包含了自主预习·悟新知,合作探究·提素养,随堂检测·精评价,碳酸钠和碳酸氢钠,焰色试验,焰色试验的操作等内容,欢迎下载使用。













