





- 2025版新教材高中化学第1章化学反应的热效应第1节反应热第1课时反应热焓变课件新人教版选择性必修1 课件 0 次下载
- 2025版新教材高中化学第1章化学反应的热效应第1节反应热第2课时热化学方程式燃烧热课件新人教版选择性必修1 课件 0 次下载
- 2025版新教材高中化学第1章化学反应的热效应微专题1ΔH的大小比较及热化学方程式的再书写课件新人教版选择性必修1 课件 0 次下载
- 2025版新教材高中化学第2章化学反应速率与化学平衡第1节化学反应速率第1课时化学反应速率课件新人教版选择性必修1 课件 0 次下载
- 2025版新教材高中化学第2章化学反应速率与化学平衡第1节化学反应速率第2课时影响化学反应速率的因素课件新人教版选择性必修1 课件 0 次下载
高中化学人教版 (2019)选择性必修1第一章 化学反应的热效应第二节 反应热的计算背景图ppt课件
展开1.通过盖斯定律的学习,理解盖斯定律,并能利用盖斯定律解决简单问题。2.通过热化学方程式、中和热、燃烧热和盖斯定律的学习,能进行反应焓变的简单计算。1.从宏观角度认识和掌握盖斯定律,培养宏观辨识和微观探析的能力。2.认识化学变化的本质是既有新物质生成又伴有能量变化,并遵循盖斯定律,培养变化观念与平衡思想。3.通过分析、推理等方法总结反应热与始态、终态的相互关系,建立认知模型,能运用模型解决有关反应热的计算。
1.内容一个化学反应,不管是一步完成的还是分几步完成的,其反应热是_______的。2.理解与特点(1)从反应途径角度理解
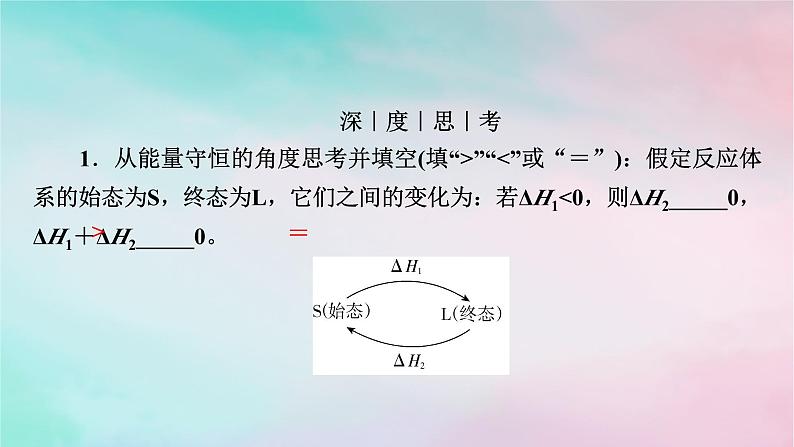
(2)从能量守恒角度理解如下图路径(Ⅰ)(Ⅱ)(Ⅲ)的反应热是相同的。(3)特点盖斯定律表明,在一定条件下,化学反应的反应热只与反应体系的_______和_______有关,而与反应的_______无关。
3.意义应用盖斯定律可以间接计算出反应很慢的或不容易直接发生的或者伴有副反应发生的反应的反应热。
正|误|判|断(1)应用盖斯定律,可计算某些难以直接测量的反应焓变。( )(2)应用盖斯定律求反应热时,可能需要调整已知热化学方程式的化学计量数为分数。( )(3)反应焓变的大小与反应的途径有关。( )(4)在相同条件下,金刚石或石墨燃烧生成1 ml CO2(g)时,放出热量相等。( )(5)盖斯定律实质上是能量守恒定律的体现。( )
深|度|思|考1.从能量守恒的角度思考并填空(填“>”“<”或“=”):假定反应体系的始态为S,终态为L,它们之间的变化为:若ΔH1<0,则ΔH2_____0,ΔH1+ΔH2_____0。
提示:不能直接测出。在氧气供应不足时,虽可生成CO,但同时还有部分CO可继续被氧化生成CO2。
(2)已知:Ⅰ.C(s)+O2(g)===CO2(g)ΔH1=-393.5 kJ·ml-1ΔH2=-283.0 kJ·ml-1
提示:①虚拟路径法反应C(s)+O2(g)===CO2(g)的途径可设计如下:则ΔH=ΔH1-ΔH2=-110.5 kJ·ml-1。②加合法分析:找唯一:C、CO分别在Ⅰ、Ⅱ中出现一次同侧加:C是Ⅰ中反应物,为同侧,则“+Ⅰ”异侧减:CO是Ⅱ中反应物,为异侧,则“-Ⅱ”调化学计量数:化学计量数相同,不用调整,则Ⅰ-Ⅱ即为运算式。所以ΔH=ΔH1-ΔH2=-110.5 kJ·ml-1。
应用盖斯定律计算ΔH的方法(1)“虚拟路径”法若反应物A变为生成物D,可以有两个途径:①由A直接变成D,反应热为ΔH;②由A经过B变成C,再由C变成D,每步的反应热分别为ΔH1、ΔH2、ΔH3。
如图所示:则:ΔH=ΔH1+ΔH2+ΔH3。(2)加合法依据目标方程式中各物质的位置和化学计量数,调整已知方程式,最终加合成目标方程式,ΔH同时作出相应的调整和运算。
应|用|体|验1.下列关于盖斯定律的说法不正确的是( )A.不管反应是一步完成还是分几步完成,其反应热相同B.反应热只与反应体系的始态和终态有关,而与反应的途径无关C.有些反应的反应热不能直接测得,可通过盖斯定律间接计算得到D.根据盖斯定律,热化学方程式中ΔH直接相加即可得总反应热
解析:盖斯定律指若一个反应可以分步进行,则各步反应吸收或放出的热量总和与这个反应一步发生时吸收或放出的热量相同,A项正确;反应物的总能量与产物的总能量决定反应热效应,所以反应热只与反应体系的始态和终态有关,而与反应的途径无关,B项正确;有些反应很慢,有的反应有副反应,其反应热通过实验测定有困难,可以用盖斯定律间接计算出来,C项正确;方程式按一定系数比加和时其反应热也按该系数比加和,D项错误。
2.下列关于如图所示转化关系(X代表卤素)的说法不正确的是( )A.ΔH3<0B.ΔH1+ΔH2+ΔH3=0C.按照Cl、Br、I的顺序,ΔH2依次减少D.一定条件下,拆开1 ml气态HX需要吸收a kJ能量,则该条件下ΔH3=-2a kJ·ml-1
解析:形成化学键放出热量,即2H(g)+2X(g)===2HX(g) ΔH3<0,A正确;由盖斯定律可知,反应一步完成与分步完成的热效应相同,则ΔH1=ΔH2+ΔH3,所以ΔH1-ΔH2-ΔH3=0,B错误;原子半径:Cl
2.实例——应用盖斯定律计算C燃烧生成CO的反应热:已知:(1)C(s)+O2(g)===CO2(g)ΔH1=-393.5 kJ·ml-1ΔH2=-283.0 kJ·ml-1
a.虚拟路径:b.应用盖斯定律求解:ΔH1=__________则:ΔH=_______________________________________________ _____________________。
ΔH1-ΔH2=-393.5 kJ·ml-1-(-283.0 kJ·ml-1)
=-110.5 kJ·ml-1
正|误|判|断(1)Na转化为Na+,吸收的能量就是该过程的反应热。( )(2)在特定条件下反应热可以等于焓变。( )(3)CO的燃烧热是283 kJ·ml-1,则反应2CO2(g)===2CO(g)+O2(g)的反应热ΔH=-566 kJ·ml-1。( )
深|度|思|考1.化学反应可视为旧键断裂和新键形成的过程。共价键的键能是两种原子间形成1 ml共价键(或其逆过程)时释放(或吸收)的能量。已知H—H键的键能为436 kJ·ml-1,Cl—Cl键的键能为243 kJ·ml-1,H—Cl键的键能为431 kJ·ml-1,则H2(g)+Cl2(g)===2HCl(g)的反应热(ΔH)等于多少?提示:ΔH=436 kJ·ml-1+243 kJ·ml-1-2×431 kJ·ml-1=-183 kJ·ml-1。
2.等质量的红磷和白磷都完全燃烧,放出的热量是否相等?请解释原因。提示:不相等。因为等质量的红磷和白磷的能量不相同,即反应物的总能量不同而生成物的总能量相同,则放出的热量不同。
应|用|体|验1.碳燃烧的过程如图所示:
则下列说法正确的是( )A.1 ml C(s)与0.5 ml O2(g)的总能量小于1 ml CO(g)的能量B.CO2(g)===C(g)+O2(g) ΔH=+393.5 kJ·ml-1C.2C(s)+O2(g)===2CO(g) ΔH=-221.0 kJ·ml-1D.等量的碳燃烧C(s)―→CO2(g)过程比C(s)―→CO(g)―→CO2(g)过程释放的能量多
2.工业上常利用CO2和NH3合成尿素[CO(NH2)2],该可逆反应分两步进行,整个过程中的能量变化如图所示。下列说法正确的是( )A.NH2COONH4为合成尿素反应的中间产物B.利用CO2和NH3合成尿素需要吸收能量C.反应Ⅱ的ΔH=-E2D.2NH3(g)+CO2(g)CO(NH2)2(l)+H2O(l)的焓变ΔH=E1-E2
3.黑火药是中国古代的四大发明之一,其爆炸的热化学方程式为S(s)+2KNO3(s)+3C(s)===K2S(s)+N2(g)+3CO2(g) ΔH=x kJ·ml-1。已知:碳的燃烧热ΔH1=a kJ·ml-1;S(s)+2K(s)===K2S(s) ΔH2=b kJ·ml-1;2K(s)+N2(g)+3O2(g)===2KNO3(s) ΔH3=c kJ·ml-1,则x为( )A.3a+b-c B.c-3a-bC.a+b-c D.c-a-b
解析:表示碳燃烧热的热化学方程式为①C(s)+O2(g)===CO2(g) ΔH1=a kJ·ml-1,将另外两个热化学方程式进行编号,②S(s)+2K(s)===K2S(s) ΔH2=b kJ·ml-1,③2K(s)+N2(g)+3O2(g)===2KNO3(s) ΔH3=c kJ·ml-1,运用盖斯定律,①×3+②-③得S(s)+2KNO3(s)+3C(s)===K2S(s)+N2(g)+3CO2(g) ΔH=(3a+b-c)kJ·ml-1,则x=3a+b-c,故A正确。
1.石墨燃烧过程中的能量变化可用下图表示。下列说法正确的是( )A.石墨的燃烧热为110.5 kg·ml-1B.1 ml石墨不完全燃烧,生成CO2和CO混合气体时,放热504 kJC.由图可知:2CO(g)+O2(g)===2CO2(g) ΔH=-566.0 kJ·ml-1D.已知C(s,金刚石)===C(s,石墨)ΔH<0,则金刚石比石墨稳定
解析:燃烧热是101 kPa时,1 ml可燃物完全燃烧生成稳定产物时的反应热,碳元素的稳定产物:C→CO2(g),据此得石墨的燃烧热为393.5 kg·ml-1,A错误;1 ml石墨不完全燃烧,由于生成CO2和CO混合气体的相对量不知,不能确定放热多少,B错误;结合选项C可知:2CO(g)+O2(g)===2CO2(g) ΔH=-566.0 kJ·ml-1,C正确;已知C(s,金刚石)===C(s,石墨) ΔH<0,则金刚石能量高于石墨,能量越低越稳定,则金刚石不如石墨稳定,D错误。
2.我国长征系列运载火箭使用的是以液氢为燃烧剂,液氧为氧化剂的高能低温推进剂,已知:(1)H2(g)===H2(l) ΔH1=-0.92 kJ·ml-1(2)O2(g)===O2(l) ΔH2=-6.84 kJ·ml-1(3)如图:
下列说法正确的是 ( )A.2 ml H2(g)与1 ml O2(g)所具有的总能量比2 ml H2O(g)所具有的总能量低B.氢气的燃烧热为ΔH=-241.8 kJ·ml-1C.液氢燃烧的热化学方程式2H2(l)+O2(l)===2H2O(g) ΔH=-474.92 kJ·ml-1D.H2O(g)变成H2O(l)的过程中,断键吸收的能量小于成键放出的能量
3.下图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理。
下列说法不正确的是( )B.通过计算,可知系统(Ⅱ)制备氢气的热化学方程式为H2S(g)===H2(g)+S(s) ΔH=+20 kJ·ml-1D.制得等量H2所需能量较少的是热化学硫碘循环硫化氢分解法
4.焦炭与水蒸气反应、甲烷与水蒸气反应均是工业上制取氢气的重要方法。这两个反应的热化学方程式分别为:①C(s)+H2O(g)===CO(g)+H2(g) ΔH1=+131.5 kJ·ml-1②CH4(g)+H2O(g)===CO(g)+3H2(g) ΔH2=+205.9 kJ·ml-1试计算CH4(g)===C(s)+2H2(g)的ΔH。答案:+74.4 kJ·ml-1
解析:分析各化学方程式的关系可以得出,将反应①的逆反应与反应②相加,得到反应:CH4(g)===C(s)+2H2(g)即:CO(g)+H2(g)===C(s)+H2O(g) ΔH3=-ΔH1=-131.5 kJ·ml-1CH4(g)+H2O(g)===CO(g)+3H2(g) ΔH2=+205.96 kJ·ml-1CH4(g)===C(s)+2H2(g) ΔH=?根据盖斯定律:ΔH=ΔH3+ΔH2=ΔH2-ΔH1=+205.9 kJ·ml-1-131.5 kJ·ml-1=+74.4 kJ·ml-1。
高中化学第二节 反应热的计算教课内容ppt课件: 这是一份高中化学第二节 反应热的计算教课内容ppt课件,共52页。PPT课件主要包含了第二节反应热的计算,新课情景呈现,课前素能奠基,盖斯定律,始态和终态,ΔH+ΔH2,课堂素能探究,3b-a4,名师博客呈现,课堂达标验收等内容,欢迎下载使用。
高中化学人教版 (2019)选择性必修1第一章 化学反应的热效应第二节 反应热的计算课文配套ppt课件: 这是一份高中化学人教版 (2019)选择性必修1第一章 化学反应的热效应第二节 反应热的计算课文配套ppt课件,共59页。PPT课件主要包含了课前·基础认知,课堂·重难突破,素养·目标定位,随堂训练,素养•目标定位,目标素养,知识概览,答案C等内容,欢迎下载使用。
化学选择性必修1第一章 化学反应的热效应第一节 反应热教课内容ppt课件: 这是一份化学选择性必修1第一章 化学反应的热效应第一节 反应热教课内容ppt课件,共58页。PPT课件主要包含了课前·基础认知,课堂·重难突破,素养·目标定位,随堂训练,素养•目标定位,目标素养,知识概览,实验装置,测量步骤,注意事项等内容,欢迎下载使用。













