


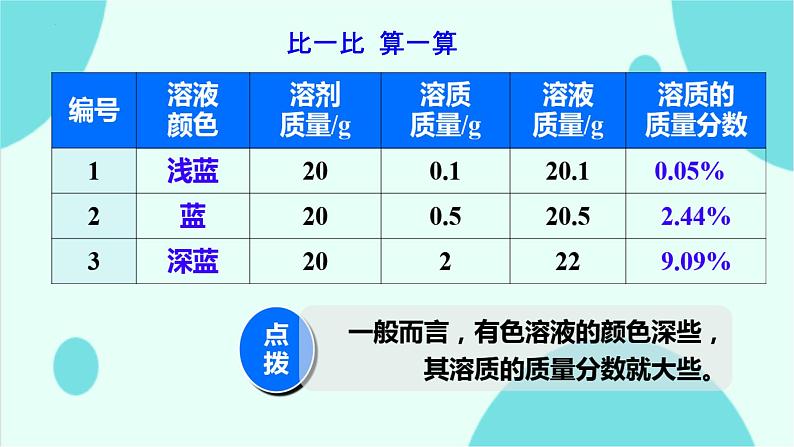


初中化学人教版九年级下册课题3 溶液的浓度教学演示ppt课件
展开溶质质量 = 溶液质量 × 溶质的质量分数
“5%的NaCl溶液”的含义
食盐的质量占整个溶液质量的5%
100g食盐溶液中含有食盐5g
每5g食盐溶于95g水形成的溶液
m食盐:m食盐溶液=5:100
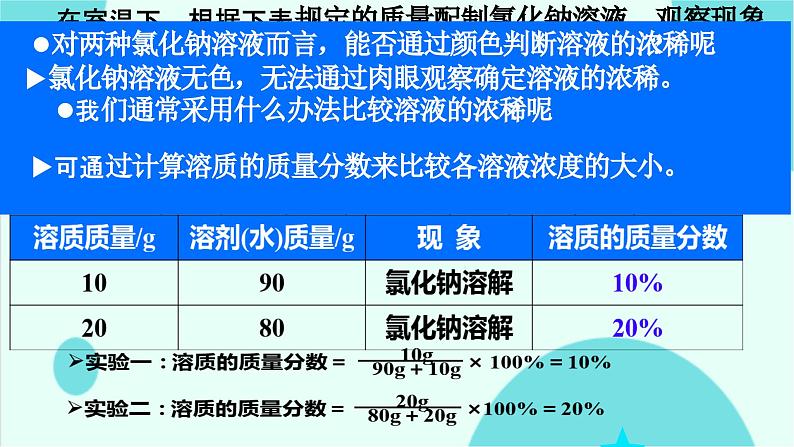
在室温下,根据下表规定的质量配制氯化钠溶液,观察现象(能否全部溶解),并计算溶液中溶质的质量分数。
对两种氯化钠溶液而言,能否通过颜色判断溶液的浓稀呢?
氯化钠溶液无色,无法通过肉眼观察确定溶液的浓稀。
我们通常采用什么办法比较溶液的浓稀呢?
可通过计算溶质的质量分数来比较各溶液浓度的大小。
讨论如何配制:称量、量取、溶解
1.从100g20%的某溶液中取出10g后,剩余溶液中溶质的质量分数是 。2.“10%的食盐溶液”含义是 。 。
学案117页,讨论1
每100g食盐溶液中含10g氯化钠
溶质质量分数计算时应注意:①溶质质量是指已溶解的质量,不一定等于加入溶剂中的物质质量。②当溶剂中所溶解的溶质不止一种时,其中某溶质的质量分数,应是这种溶质质量占全部溶液质量的百分比。③溶质质量分数只有在溶解度范围内才有意义。
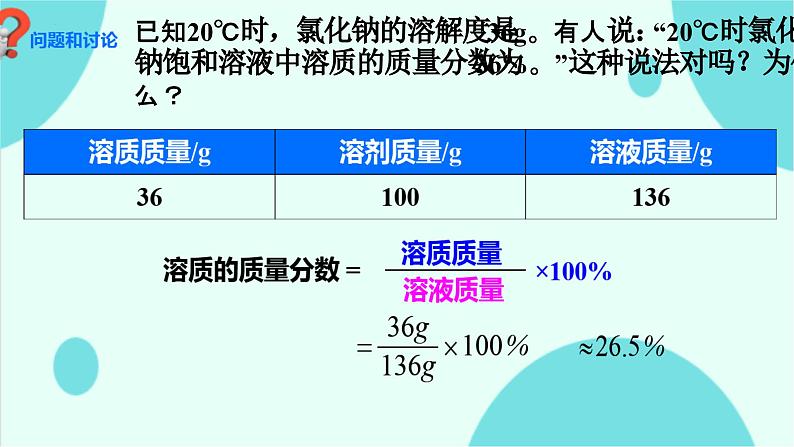
已知20℃时,氯化钠的溶解度是36g。有人说:“20℃时氯化钠饱和溶液中溶质的质量分数为36%。”这种说法对吗?为什么?
溶质质量分数与溶解度的联系和区别
溶质的质量分数36% 是指每 100g溶液中含有36g溶质。 t ℃时某物质溶解度36g是指 在t ℃ 时,100g水最多溶解该溶质36g。
一定温度下,某物质饱和溶液溶质的质量分数
一定温度下,某物质饱和溶液的质量分数是最大的,且是一定的。
【拓展练习】1.已知20℃时,氯化钠的溶解度是36g,在20℃时,将20g氯化钠放入50g水中充分溶解后,求所得溶液中溶质的质量分数。
答:所得溶液中溶质的质量分数为26.5% 。
所得溶液中溶质的质量分数
由题意分析知,20gNaCl放在50g水中,溶液达到饱和,只能溶解18gNaCl
2.将氯化钠和氯化钾的混合物20g(其中含有5g的氯化钠)放入盛有80g水的烧杯内,充分搅拌,完全溶解,则所得溶液中氯化钾的质量分数 。
答:所得溶液中溶质的质量分数为15% 。
氯化钾的质量=20g-5g=15g
所得溶液的质量=20g+80g=100g
在农业生产中,常需要用质量分数为16%的氯化钠溶液来选种。现要配制150kg这种溶液,需要氯化钠和水的质量各是多少?
答:需要氯化钠24kg,水126kg。
【巩固练习】现有50g质量分数为5%的氯化钠溶液,计算通过下列方法后所得溶液的溶质质量分数。(1)向原溶液中加入2.5g氯化钠晶体全部溶解。(2)向原溶液中加入50g水。(3)把溶剂蒸发掉25g水(无晶体析出)。(写出解答过程)解:
50g×5%=2.5g
答:(1)所得溶液的溶质质量分数9.5%;(2)所得溶液的溶质质量分数2.5%;(3)所得溶液的溶质质量分数10%;
所得溶液中溶质的质量分数=
1.某溶液中溶质的质量分数为20%,则下列质量比关系不正确的是( )A.溶质:溶剂=1:4 B.溶质:溶液=1:5C.溶剂:溶液=4:5 D.溶质:溶剂=1:52.一定温度下,蒸发某溶液至有少量晶体析出时,保持不变的是( )A.溶液的质量 B.溶质的质量C.溶质的溶解度 D.溶质的质量分数3.一定温度下的饱和食盐水里加入少量的硝酸钾晶体,则( )①硝酸钾晶体不溶,②硝酸钾晶体溶解,③溶液中食盐的质量分数不变,④溶液中食盐的质量分数减小,⑤溶液中食盐的质量分数增大。 A.①③ B.②③ C.②④ D.②⑤
4.某温度时,向一定量的饱和石灰水中加入少量的生石灰,恢复到原来的温度。下列说法中正确的是( )A.溶液的质量减少 B.溶液的质量不变C.溶液中溶质的质量分数增大 D.溶液中溶质的溶解度增大
5.甲、乙、丙三种固体物质的溶解度曲线如图,回答问题:(1)甲、乙、丙三种固体物质溶解度受温度影响最大的是 (2)欲将t1 ℃时乙物质的不饱和溶液转化为该温度下的饱和溶液,可采取的方法是 (3)氧气的溶解度随温度变化的规律与图中的 (填“甲”、 “乙”或、 “丙 ”相 似)。(4)下列说法正确的是 A.甲、乙两物质溶液的溶质质量分数相等B.t2 ℃配制300g甲的饱和溶液,需要固体甲的质量为100gC.t2 ℃甲、乙、丙三种饱和溶液降温到t1 ℃,甲析出晶体的质量比乙多D.t1 等质量的甲、乙、丙三种固体配制成该温度下的饱和溶液,所得溶液的质量大小丙>甲=乙。(5)在t2℃时,将接近饱和的丙物质的溶液变为饱和溶液,下列有关分析正确的是 ①溶质的质量一定不变; ②溶剂的质量可能不变;③溶液的质量一定增大; ④溶液中溶质的质量一定不变;
6.右图是甲、乙、丙三种物质的溶解度曲线。(1)t2℃时,甲的溶解度为 。(2)t3℃时,甲乙各50g分别加入到100g水中充分搅拌,其中不能形成饱和溶液的是 。(3)t3℃时,甲的饱和溶液中含有少量的乙,现要提纯乙可采用的方法是 。(4)下列说法正确的是 。A.将甲、乙的饱和溶液分别从t1℃升温到t2℃,溶质的质量分数都不变。B. t2℃时,向100g20%甲的饱和溶液中加100g水,充分搅拌,溶液的浓度为10%。C. t3℃时,等质量的甲、乙、丙分别制成饱和溶液,需水的质量最多的是甲。D.升高丙溶液的温度,一定有晶体析出
7.如图是甲乙两种固体物质的溶解度曲线图,回答:(1) ℃时,甲、乙两种物质的溶解度相同(2)将t1℃时甲的饱和溶液变成不饱和溶液可采用的方法是(3)t2℃时,将25g甲放入100g水中发现固体先全部溶解,一段时间后又有晶体析出,请你解释甲固体先全部溶解的原因(4)下列说法中正确的是 (填序号)①甲中含有少量乙,可以采用降温结晶的方法提纯甲②t2℃时,甲溶液溶质的质量分数比乙溶液大③t2℃时,将等质量的甲乙两物质分别加水溶解配制成饱和溶液,甲溶液的质量比乙溶液质量小④将t1℃甲乙的饱和溶液升温到t2℃时,甲乙溶液溶质的质量分数都不变
甲物质溶于水溶液温度升高,甲物质溶解度升高至不小于25克
饱和溶液、不饱和溶液与浓溶液、稀溶液之间的关系
食盐溶解食盐的不饱和溶液
熟石灰不完全溶解熟石灰的饱和溶液
①对于不同溶质来说,浓溶液不一定是饱和溶液,稀溶液也不一定是不饱和溶液。
②对于同种溶质来说:在一定温度时饱和溶液比不饱和溶液要浓。
溶液的浓稀与溶液是否饱和没有必然的联系:①浓溶液 是饱和溶液,不饱和溶液也 是稀溶液。②同温下,同种溶质的饱和溶液 比不饱和的要浓。
溶液在一定条件下可分为饱和溶液和不饱和溶液
不给定条件可分为浓溶液和稀溶液。
一、溶液浓度的表示方法------溶质的质量分数
溶质质量与溶液质量之比。
4、影响质量分数大小的因素是 的质量和 的质量,与溶液温度无关。
溶质的质量=溶液质量×溶质质量分数 溶液质量=溶质的质量÷溶质质量分数(或=溶质的质量+溶剂的质量)
人教版九年级下册课题3 溶液的浓度教课课件ppt: 这是一份人教版九年级下册<a href="/hx/tb_c76882_t3/?tag_id=26" target="_blank">课题3 溶液的浓度教课课件ppt</a>,共27页。PPT课件主要包含了学习目标,创设情境引入新课,喷洒农药,自制汽水,勺白糖,适量果汁,5g小苏打,5g柠檬酸,生成二氧化碳,稀释溶液等内容,欢迎下载使用。
化学九年级下册课题3 溶液的浓度评优课ppt课件: 这是一份化学九年级下册<a href="/hx/tb_c76882_t3/?tag_id=26" target="_blank">课题3 溶液的浓度评优课ppt课件</a>,共28页。PPT课件主要包含了溶液的浓度,20ml水,44%,09%,完全溶解,≈265%等内容,欢迎下载使用。
人教版九年级下册课题3 溶液的浓度课堂教学ppt课件: 这是一份人教版九年级下册<a href="/hx/tb_c76882_t3/?tag_id=26" target="_blank">课题3 溶液的浓度课堂教学ppt课件</a>,共34页。PPT课件主要包含了创设情境,学习目标,溶液的浓度,体积分数,溶质的质量分数,12g,100g-12g,88g,10g÷20%,50g等内容,欢迎下载使用。













