





高中人教版 (2019)第二节 元素周期律课前预习ppt课件
展开元素周期表与周期律的关系
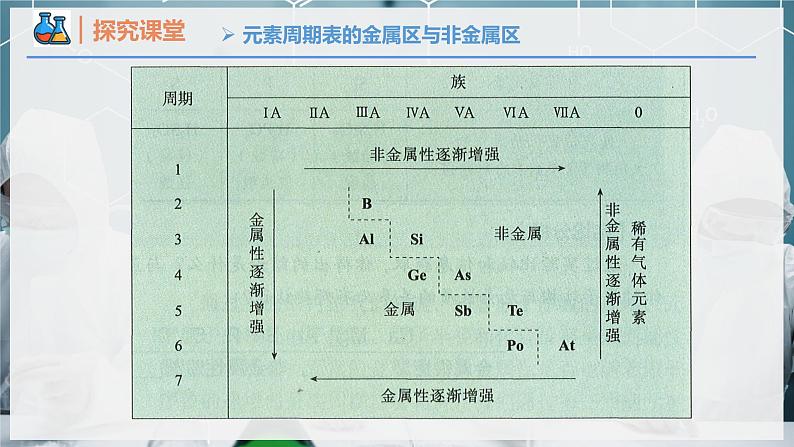
元素周期表的金属区与非金属区
元素周期表与周期律的应用
他查看门捷列夫的化学元素周期表,发现只有位于周期表右边的非金属元素能生成在室温下呈气态的化合物,同时他还注意到化合物的可燃性从左到右依次减小,比如:甲烷很容易燃烧,氨就很不容易了,水和氟化氢则是怎么都烧不起来,因此,卤化物是非常好的阻燃剂。从下往上看,溴的毒性太大,也太容易被氧化,因此他考虑用氟、氯化合物来做新型制冷剂。有了好的想法和思路,工作起来就更加得心应手,仅仅用了三天,他就合成出二氟二氯甲烷(即CFC-12,R12)
最早的制冷剂是氨或者二氧化硫,非常不环保。1929年,发生在俄亥俄州克利夫兰某家医院的冰箱泄漏事故使超过100人丧生。这起事件让美国人托马斯·米奇利心情十分沉重,他想,必须要研制一种稳定、不易燃、不腐蚀且无毒的新型制冷剂。
托马斯·米奇利好的想法和思路是如何来的?
元素周期表与元素周期律的关系
元素周期表是元素周期律的具体表现形式,反映了元素之间的内在联系。
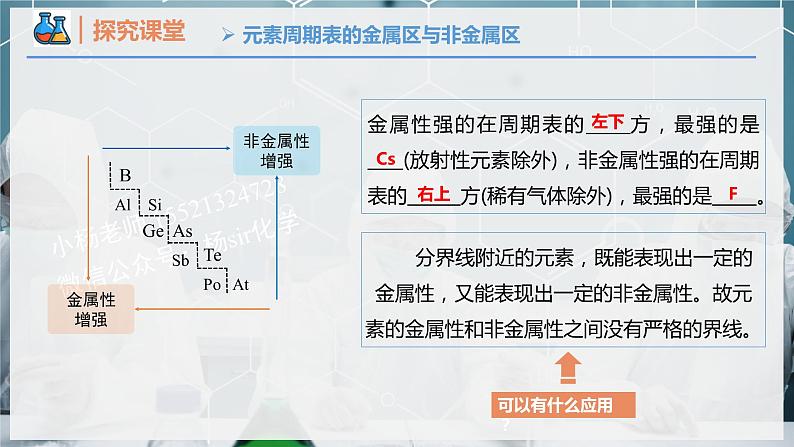
分界线附近的元素,既能表现出一定的金属性,又能表现出一定的非金属性。故元素的金属性和非金属性之间没有严格的界线。
金属性强的在周期表的_____方,最强的是____(放射性元素除外),非金属性强的在周期表的______方(稀有气体除外),最强的是_____。
在金属与非金属分界线附近寻找半导体材料,如:Si、Ge、Ga等;
元素周期表和周期律的应用
研究氟、氯、硫、磷附近的元素,制造新品种农药;
在过渡元素中寻找制造催化剂和耐高温、耐腐蚀合金的元素,如:Fe、Ni、Pd等。
【例1】元素周期表在指导科学研究和生产实践方面具有十分重要的意义,请将下表中A、B两栏描述的内容对应起来。
应用二:指导新元素的发现及预测他们的原子结构和性质
通过位置预测物质性质通过性质判断元素位置
Oganessn是一种人工合成的化学元素,原子量为297,半衰期12毫秒(百分之一秒)。属于气体元素,化学性质很不活泼。属于稀有气体一类。 Og具放射性,其原子十分不稳定。
第七周期第0族(稀有气体)
【例2】镭是第7周期第ⅡA族元素,下列关于镭的性质的描述中不正确的是( ) A. 镭比钙金属性更强 B. 氢氧化物呈两性 C. 在化合物中呈+2价 D. 碳酸盐难溶于水
应用三:比较元素的性质
【例3】已知下列顺序,其中错误的是( )。 A.氢化物的稳定性依次增强:HF、H2O、NH3 B.酸性依次减弱:HClO4、HBrO4、HIO4 C.还原性依次增强:Al、Mg、Na D.非金属性依次减弱:Cl、S、P
【例4】 X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示。若Y原子的最外层电子数是次外层电子数的3倍,则下列说法中正确的是( ) A.原子半径: W > Z > Y > XB. 最高价氧化物对应的水化物的酸性: Z > W > XC. W单质能与水反应生成两种强酸D.四种元素的单质中,只有Z单质在常温常压下是固体
【练习1】关于元素周期表,下列叙述中不正确的是( )A.在金属元素与非金属元素的分界线附近可以寻找制备半导体材料的元素B.在过渡元素中可以寻找制备催化剂及耐高温和耐腐蚀的元素C.在非金属元素区域可以寻找制备新型农药材料的元素D.在地球上元素含量的分布和它们在元素周期表中的位置有密切关系
【练习2】下列事实不能作为元素的金展性或非金属性强弱判断依据的是( )A.Zn和Fe分别与稀硫酸反应,判断金属性强弱:Zn>FeB.Mg投入CuCl2溶液中能置换出铜,Ba 投入CuCl2溶液中不能置换出铜,判断金属性强弱:Mg>BaC.酸性:H2SiO3
【练习4】四种短周期元素在元素周期表中的位置如图所示,T是地壳中含量最高的金属元素。下列说法不正确的是( )A.W的氢化物比R的氢化物稳定B.T的最高价氧化物对应的水化物可能为强碱C.Q的原子半径比T的小D.W和Q的原子序数相差10
高中化学第二节 元素周期律说课ppt课件: 这是一份高中化学第二节 元素周期律说课ppt课件,共24页。
高中化学人教版 (2019)必修 第一册第二节 元素周期律评课ppt课件: 这是一份高中化学人教版 (2019)必修 第一册第二节 元素周期律评课ppt课件,共24页。
高中化学必修一 专题4.2.2 元素周期表和周期律的应用备课堂课件)): 这是一份高中化学必修一 专题4.2.2 元素周期表和周期律的应用备课堂课件)),共20页。













