







人教版 (2019)选择性必修2第三章 晶体结构与性质第四节 配合物与超分子精品教学设计及反思
展开宏观辨识与微观探析: 能从微观角度理解配位键的形成条件和表示方法,能判断常见的配合物。了解超分子的概念及特性。证据推理与模型认知: 能利用配合物的性质去推测配合物的组成,从而形成“结构决定性质”的认知模型。科学探究与创新意识: 学习超分子,提升学生的科学精神与社会责任。
1.能从微观角度理解配位键的形成条件和表示方法,能判断常见的配合物。2.了解超分子的概念及特性。重点:能从微观角度理解配位键的形成条件和表示方法,能判断常见的配合物。难点:能从微观角度理解配位键的形成条件和表示方法,能判断常见的配合物。
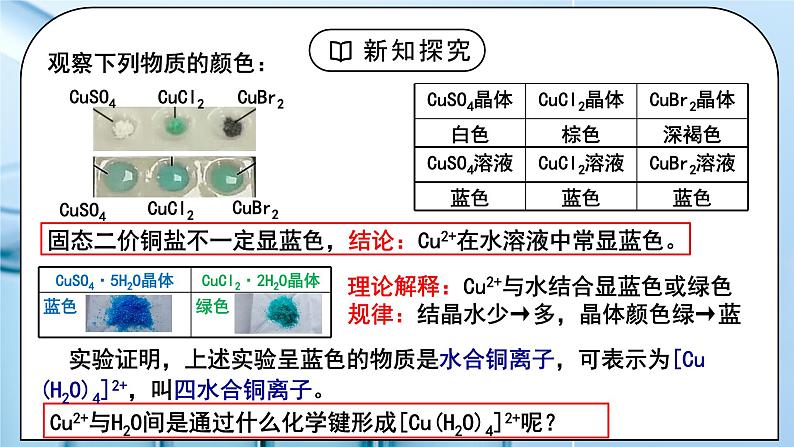
思考:无水CuSO4固体是白色的,但CuSO4·5H2O晶体却是蓝色的,为什么呢?
CuSO4
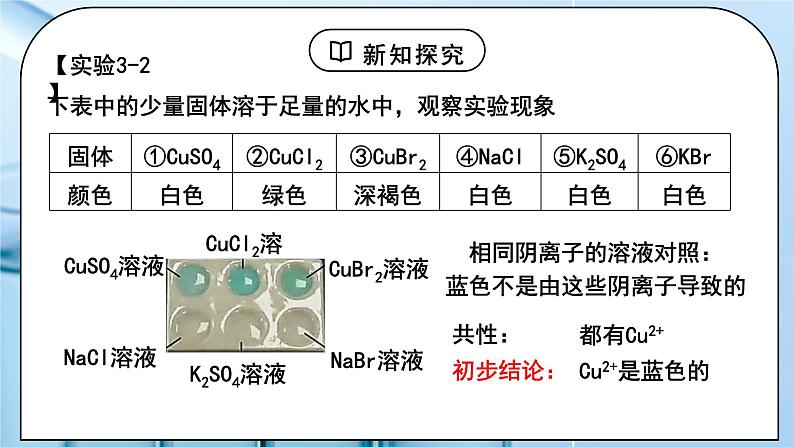
下表中的少量固体溶于足量的水中,观察实验现象
相同阴离子的溶液对照:蓝色不是由这些阴离子导致的
固态二价铜盐不一定显蓝色,结论:Cu2+在水溶液中常显蓝色。
理论解释:Cu2+与水结合显蓝色或绿色规律:结晶水少→多,晶体颜色绿→蓝
Cu2+与H2O间是通过什么化学键形成[Cu(H2O)4]2+呢?
实验证明,上述实验呈蓝色的物质是水合铜离子,可表示为[Cu(H2O)4]2+,叫四水合铜离子。
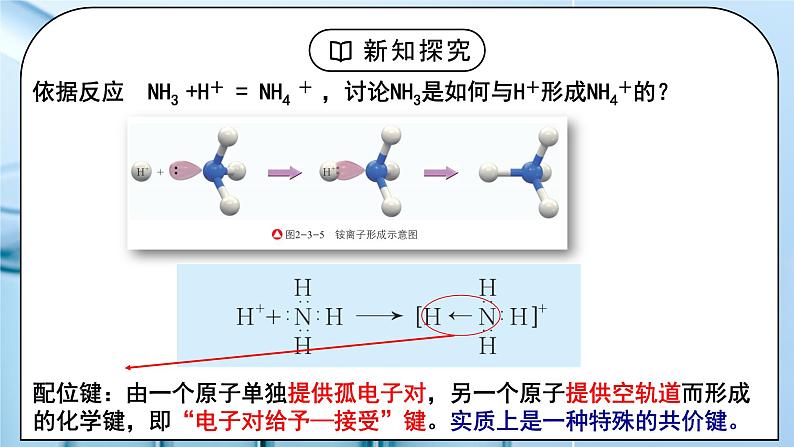
依据反应 NH3 +H+ = NH4 + ,讨论NH3是如何与H+形成NH4+的?
配位键:由一个原子单独提供孤电子对,另一个原子提供空轨道而形成的化学键,即“电子对给予—接受”键。实质上是一种特殊的共价键。
类比NH4+ 的形成,推测Cu2+与H2O间是怎样形成[Cu(H2O)4]2+的?
[Cu(H2O)4]2+
Cu2+的价层电子构型3d9, 4s和4p轨道是空的。
[Cu(H2O)4]2+的形成
由一个原子单独提供孤电子对,另一个原子提供空轨道而形成的化学键,即“电子对给予—接受”键。
①成键原子一方要有孤电子对
如 NH3、H2O、CO、有机胺等分子;卤离子 、OH-、CN-、SCN-等离子。
②成键原子另一方有空轨道
一般是过渡金属的原子或离子如:Fe3+、Cu2+、Zn2+、Ni2+、C3+、Ag+、Cr3+、Ni ; 还有H+、Al3+、B、Mg2+等主族元素
配位键是一种特殊的共价键,同样具有饱和性和方向性。一般来说,多数过渡金属的原子或离子形成配位键的数目是基本不变的,如Ag+形成2个配位键;Cu2+形成4个配位键等。
(电子对给予体)A→B(电子对接受体)或A—B。
依据电子式,讨论NH3 、H2O与H+是如何形成NH4+ 、H3O+的?
配合物溶于水易电离为内界配离子和外界离子,内界配离子一般很稳定,不易电离。有些配合物不存在外界
把金属离子或原子(称为中心离子或原子)与某些分子或离子(称为配体或配位体)以 配位键 结合形成的化合物称为配位化合物,简称配合物。
如[Cu(NH3)4]SO4、[Ag(NH3)2]OH等。
①中心原子(离子):提供空轨道的金属离子或原子。一般是过渡金属,必须有空轨道。
②配位体:含有孤电子对的分子或离子NH3 H2O CO Cl- SCN- CN-
③配位原子:配位体中具有孤电子对原子N O P S,一般是ⅤA Ⅵ A ⅦA的非金属原子
④配位数:直接同中心原子配位的原子数目,一般是2、4、6、8
⑤配离子的电荷:等于中心离子和配体总电荷的代数和,如:[Fe(SCN)6]3-
注意:①有的配合物没有外界,如 Ni(CO)4 , Fe(CO)5等。
②NH4Cl中含配位键,但不是配位化合物。配合物一定含有配位键
【课堂练习】完成下表:
[Ag(NH3)2]+
[Fe(CN)6]3-
[C(NH3)5Cl]2+
Na[Al(OH)4]
反应①:Cu2+ + 2NH3·H2O = Cu(OH)2↓+2NH4+
反应②:Cu(OH)2 + 4NH3= [Cu(NH3)4](OH)2
溶剂极性:乙醇 < 水[Cu(NH3)4]SO4·H2O在乙醇中的溶解度小
因为H2O、NH3同为中性分子,但电负性N<O,N比O更容易给出孤对电子,与Cu2+形成的配位键更强。
配位键的强度有大有小,有的配合物较稳定,有的配合物较不稳定。通常情况,较稳定的配合物可以转化为稳定性更强的配合物。
Fe3++nSCN- = [Fe(SCN)n]3-n
n = 1-6,随SCN-的浓度而异
利用硫氰化铁配离子等颜色,可用于鉴别溶液中存在Fe3+;
又由于硫氰化铁配离子的颜色极似血液,常被用于电影特技和魔术
在一定条件下, 配位键比较稳定,配离子不易发生电离。
写出K3[Fe(CN)6]的电离方程式
生成 [Fe(SCN)n]3-n (n = 1~6)
[Fe(CN)6]3-很难电离出 Fe3+
K3[Fe(CN)6] = 3K++ [Fe(CN)6]3-
配离子 [Fe(CN)6]3-的中心离子Fe3+、配体CN-、配位数6、 [Fe(CN)6]3-与Fe3+性质不一样
简单离子和配离子的区别(104页实验2)
Ag++Cl- = AgCl ↓
AgCl + 2NH3 = [Ag(NH3)2]++Cl-
(1)对溶解性的影响:一些难溶于水的金属氢氧化物、氯化物、溴化物、碘化物、氰化物,可以溶解于氨水中,或依次溶解于含过量的OH-、Cl-、Br-、I-、CN-的溶液中,形成可溶性的配合物。
(2)颜色的改变:当简单离子形成配离子时,其性质往往有很大差异。颜色发生变化就是一种常见的现象,根据颜色的变化就可以判断是否有配离子生成。
CuCl难溶于水,可溶于浓盐酸和氨水
4、配合物的形成对性质的影响
(3)稳定性增强①配合物具有一定的稳定性,配合物中的配位键越强,配合物越稳定。②许多过渡金属元素的离子对多种配体具有很强的结合力,因而,过渡金属配合物远比主族金属配合物多。③当作为中心离子的金属离子相同时,配合物的稳定性与配体的性质有关。例如,血红素中的Fe2+与CO分子形成的配位键比Fe2+与O2分子形成的配位键强,因此血红素中的Fe2+与CO分子结合后,就很难再与O2分子结合,血红素失去输送氧气的功能,从而导致人体CO中毒。
电负性:F>H,使得NF3提供孤电子对的能力小于NH3。
思考:(1)人体内血红蛋白是Fe2+卟啉配合物,Fe2+与O2结合形成配合物,而CO与血红蛋白中的Fe2+也能形成配合物。根据生活常识,比较其配合物的稳定性。
血红蛋白中Fe2+与CO形成的配合物更稳定。
(2)[Cu(NH3)4]2+与[Cu(H2O)4]2+哪个配位离子更稳定?原因是什么?
[Cu(NH3)4]2+更稳定。因为N和O都有孤电子对,但O的电负性大,吸引孤电子对的能力强,故NH3提供孤电子对的能力比H2O大。
(3)NH3与Cu2+形成配合物,但NF3很难与Cu2+形成配合物,原因是什么?
电解氧化铝的助熔剂 Na3[AlF6]
热水瓶胆镀银(银镜反应) [Ag(NH3)2]OH
(1)在生产、生活中的应用
(2)生命体中的应用
第二代铂类抗癌药(碳铂)
由两种或两种以上的分子通过分子间相互作用形成的分子聚集体称为超分子。分子是广义的,包括离子。
超分子是组成复杂的,有组织的分子聚集体,并保持一定的完整性使其具有明确的微观结构和宏观特性。
3、特性(1)分子间相互作用:通过非共价键结合,包括范德华力、氢键、静电作用。
(2)分子聚集体大小:
有的是有限的 有的是无限伸展的
双螺旋DNA的两条分子链是通过氢键给体和受体的结合关系来实现分子识别的
常见的DNA碱基配对结构
A T
G C
DNA碱基对是通过氢键相互识别并结合的
错开后空间结构不匹配,不能形成稳定结构
②分离 C60 和 C70
杯酚与C60通过范德华力相结合,通过尺寸匹配实现分子识别
15-冠-5 填充模型
12-冠-4 球棍模型
C 原子:2×4 = 8 O 原子:4 8 + 4 = 12
C 原子:2×5 = 10 O 原子:5 10 + 5 = 15
冠醚是皇冠状的分子,可有不同大小的空穴适配不同大小的碱金属离子
表3-6 冠醚识别钾离子
18-冠-6–K+超分子
冠醚与金属阳离子通过配位作用相结合,不同大小的冠醚可以识别不同大小的碱金属离子。
冠醚环的大小与金属离子匹配,才能识别
冠醚能与阳离子尤其是碱金属阳离子作用,并且随环的大小不同而与不同的金属离子作用,将阳离子以及对应的阴离子都带入有机溶剂,因而成为有机反应中很好的催化剂。
超分子应用举例:相转移催化剂
高锰酸钾溶液可以氧化甲苯,从而褪色。 但是高锰酸钾溶解在水中,难溶于甲苯,难以和甲苯充分接触;将甲苯和18-冠-6混合后与高锰酸钾水溶液反应,可以加快反应速率。
超分子组装的过程称为分子自组装,自组装过程是使超分子产生高度有序的过程。
表面活性剂:从分子结构上说,也可以叫“两亲分子”,一端为亲水基团,另一端为疏水基团。
硬脂酸根(传统肥皂的有效成分之一)
十二烷基苯磺酸根(合成洗涤剂中常用的表面活性剂)
低浓度时,优先在溶液表面形成单分子层,降低表面张力。高浓度时,剩余的表面活性剂在溶液中形成胶束。
烷基磺酸根离子在水中自组装为胶束
人体细胞和细胞器的膜是双分子膜,双分子膜是由大量两性分子(一端有极性、另一端无极性)组装而成的。为什么双分子膜以头向外而尾向内的方式排列?这是由于细胞膜的两侧都是水溶液,水是极性分子,而构成膜的两性分子的头基是极性基团而尾基是非极性基团。
超分子技术在催化、分析、药物合成、染料合成等领域都有应用。
已报道的超分子大环主体有:DNA,冠醚,环糊精,杯芳烃,杯吡咯,杯咔唑,瓜环胡葫芦脲,柱芳烃等。
练习1、以下微粒①H3O+,②CH4,③OH-,④NH4+,⑤Fe(CO)3,⑥Fe(SCN)3,⑦H3O+,⑧Ag(NH3)2OH,含配位键的是( ) A.①②④⑦⑧ B.③④⑤⑥⑦C.①④⑤⑥⑦⑧ D.全部
练习2、向下列配合物的水溶液中加入AgNO3溶液,不能生成AgCl沉淀的是( )
A.[C(NH3) 4Cl2]Cl
B.[C(NH3) 3Cl3]
C.[C(NH3) 6]Cl3
D.[C(NH3) 5Cl]Cl2
练习3、 向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色的透明溶液。下列对此现象说法正确的是( ) A. 反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变。 B. 沉淀溶解后,将生成深蓝色的配合离子[Cu(NH3)4] 2+。 C. 向反应后的溶液加入乙醇,溶液将会没有发生变化,因为[Cu(NH3)4] 2+ 。不会与乙醇发生反应。 D. 在[Cu(NH3)4] 2+ 离子中, Cu2+给出孤对电子,NH3提供空轨道。
把金属离子或原子(称为中心离子或原子)与某些分子或离子(称为配体或配位体)以 配位键 结合形成的化合物称为配位化合物,简称配合物。
高中化学人教版 (2019)选择性必修2第二节 分子晶体与共价晶体优质第二课时教学设计: 这是一份高中化学人教版 (2019)选择性必修2第二节 分子晶体与共价晶体优质第二课时教学设计,文件包含核心素养人教版高中化学选修二《分子晶体与共价晶体》第二课时课件pptx、核心素养人教版高中化学选修二《分子晶体与共价晶体》第二课时教学设计含教学反思docx等2份教案配套教学资源,其中教案共9页, 欢迎下载使用。
高中化学人教版 (2019)选择性必修2第二节 分子晶体与共价晶体优质第一课时教案: 这是一份高中化学人教版 (2019)选择性必修2第二节 分子晶体与共价晶体优质第一课时教案,文件包含核心素养人教版高中化学选修二《分子晶体与共价晶体》第一课时课件pptx、核心素养人教版高中化学选修二《分子晶体与共价晶体》第一课时教学设计含教学反思docx等2份教案配套教学资源,其中教案共7页, 欢迎下载使用。
人教版 (2019)选择性必修2第三节 分子结构与物质的性质精品第二课时教学设计: 这是一份人教版 (2019)选择性必修2第三节 分子结构与物质的性质精品第二课时教学设计,文件包含核心素养人教版高中化学选修二《分子结构与物质的性质》第二课时课件pptx、核心素养人教版高中化学选修二《分子结构与物质的性质》第二课时教学设计含教学反思docx等2份教案配套教学资源,其中教案共7页, 欢迎下载使用。














