







高中化学人教版 (2019)选择性必修2第三节 分子结构与物质的性质获奖第一课时教学设计
展开(人教版高中化学选择性必修2)
《分子结构与物质的性质》第一课时 教学设计
课题名 | 《分子结构与物质的性质》第一课时 |
教材分析 | 本节课从键的极性对化学性质的影响拓展到分子结构对化学性质的影响,主要阐述了共价键的极性对某些羧酸酸性强弱的影响,进一步认识物质结构与物质性质的关系,让学生树立物质结构决定物质化学性质的化学观念。 |
核心素养 | 宏观辨识与微观探析:掌握共价键可分为极性共价键和非极性共价键。区分极性分子和非极性分子,了解分子极性与分子中键的极性及分子空间结构密切相关。掌握键的极性对化学性质的影响,能从分子的结构判断羧酸的酸性大小。 证据推理与模型认知:知道分子可以分为极性分子和非极性分子。能根据分子的结构特点和键的极性判断分子的极性,发展宏观辨识和微观探析的学科核心素养。 科学探究与创新意识:认识科学探究是进行科学解释和发展、创造和应用的科学实践活动。 |
教学重点 | 共价键可分为极性共价键和非极性共价键,能区分极性分子和非极性分子,掌握键的极性对化学性质的影响。 |
教学难点 | 了解分子极性与分子中键的极性及分子空间结构密切相关。 |
教学方法 | 讲解,举例 |
教学准备 | 教师准备:PPT 学生准备:预习课本 |
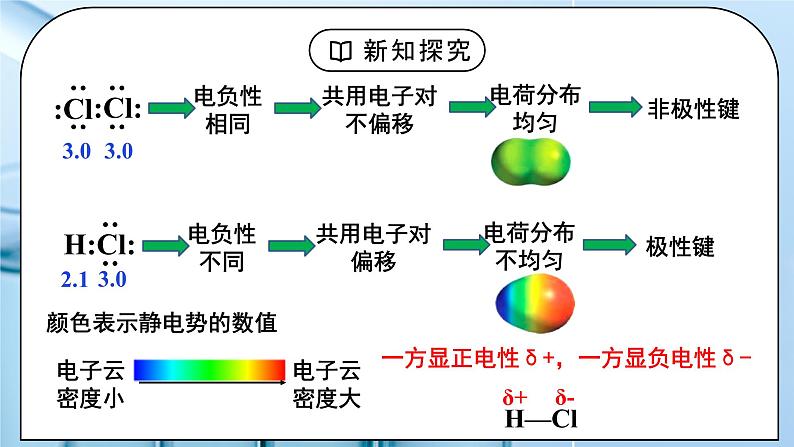
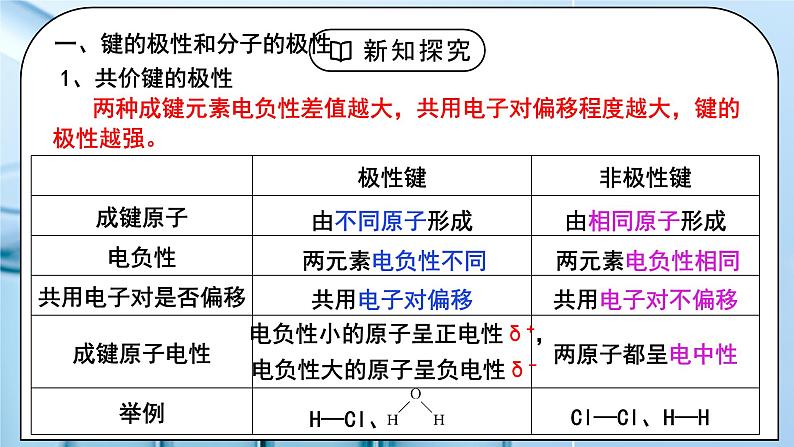
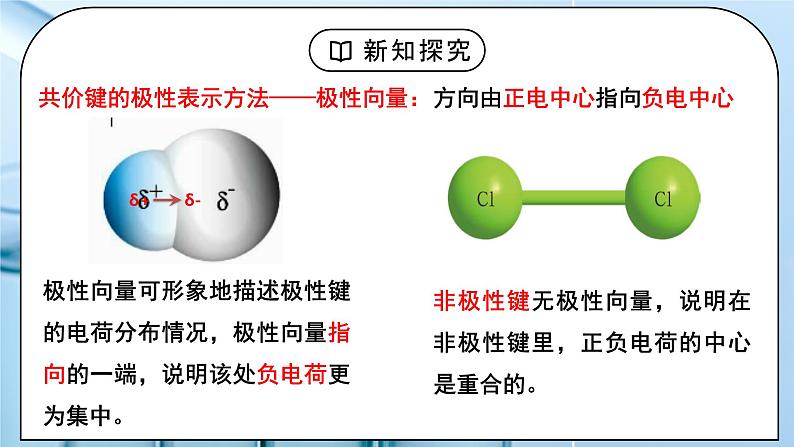
教学过程 | 一、新课导入 1.共价键的类型 教师:按照不同的分类方法,可将共价键分为不同的类型: (1)按共用电子对数目 单键:如H-H键 双键:如C=C键 三键:如N≡N键 (2)按共用电子对是否偏移 非极性键:如Cl-Cl键 极性键:如H-Cl键 (3)按原子轨道的重叠方式 σ键 π键 学生:复习回顾按照不同的分类方法,可将共价键分为不同的类型。 [设计意图]通过复习回顾按照不同的分类方法,可将共价键分为不同的类型,引入键的极性和分子的极性的学习。 二、探究新知 1.一、键的极性和分子的极性 教师:思考:为什么同种元素的共用电子对不偏移,而不同种元素的共用电子对发生偏移? 不同元素的原子对共用电子对的吸引力不同,即元素的电负性不同。 1、共价键的极性 两种成键元素电负性差值越大,共用电子对偏移程度越大,键的极性越强。 共价键的极性表示方法——极性向量:方向由正电中心指向负电中心 极性向量可形象地描述极性键的电荷分布情况,极性向量指向的一端,说明该处负电荷更为集中。 非极性键无极性向量,说明在非极性键里,正负电荷的中心是重合的。 2、分子的极性: ①分类:极性分子: 正电中心和负电中心不重合的分子 非极性分子: 正电中心和负电中心重合的分子 常见的极性分子和非极性分子 ②分子极性的判断方法: 方法一:根据正电中心和负电中心是否重合来判断: 若正电中心和负电中心不重合—极性分子 若正电中心和负电中心重合—非极性分子 方法二:根据化学键的极性的向量和是否为0来判断: 若分子中各个键的极性的向量和等于零, 则为非极性分子(极性抵消) 只含非极性键的分子一定是非极性分子。 如: H2、O2 、P4、C60、S8、Cl2 等单质(O3例外) 若分子中各个键的极性的向量和不等于零, 则为极性分子(极性不抵消) C=O键是极性键,CO2是直线形、结构对称,两个C=O的极性互相抵消,所以整个分子没有极性,电荷分布均匀,是非极性分子。 平面三角形,结构对称,键的极性互相抵消 ,是非极性分子 正四面体形 ,结构对称,键的极性互相抵消,是非极性分子 若正电中心和负电中心重合(分子空间结构对称),为非极性分子。 O-H键是极性键,分子是V形不对称分子,两个O-H键的极性不能抵消,整个分子电荷分布不均匀,是极性分子。 三角锥形, 不对称分子,键的极性不能抵消,是极性分子。 若正电中心和负电中心不重合(分子空间结构不对称),则为极性分子。 方法三:根据分子中心原子有无孤电子对来判断来判断: 多原子分子(原子数≥3) 若中心原子无孤电子对且键长均相等,则为非极性分子;如:CH4 如:NH3 (有孤电子对)、 CH3CI(无孤电子对但键长不同) 注意:单质双原子分子是非极性分子,非单质双原子分子是极性分子。 方法四:根据分子的空间结构是否对称来判断: 若对称,则为非极性分子 若不对称,则为极性分子 方法五:根据中心原子的化合价来判断 方法五:根据中心原子的化合价来判断 【思考讨论】(1)以下双原子分子中,哪些是极性分子,哪些是非极性分子?H2 O2 Cl2 HCl (2)P4和C60是极性分子还是非极性分子? (3)以下化合物分子中,哪些是极性分子,哪些是非极性分子? CO2 HCN H2O NH3 BF3 CH4 CH3Cl 资料卡片:试分析为什么O3分子中共价键是极性键? O3分子结构为V形(如图),根据VSEPR模型,中心氧原子的价层电子对数为3,得出VSEPR模型为平面三角形,中心氧原子为sp2杂化,和2个端位氧原子形成两个σ键,还有1对未参与杂化的孤电子对垂直于该平面,并与两个键合氧原子各提供的1个电子形成离域π键— (如下图),所以中心氧原子和两个端位的氧原子之间的共用电子对会发生偏移,因此为极性键。 判断分子的极性可依据分子中化学键的极性的向量和。O3分子中化学键为极性键,分子结构为V形,所以键的极性的向量和不为0,即分子为极性分子。 试分析为什么O3、H2O2是极性分子? 因为臭氧分子中,氧分子是呈折线型的,三个氧原子形成角形,或者是V形,这样就会导致正负电荷中心不重合,所以它们的合力不为氧分子,因此臭氧是为极性分子。 物质极性的判断不能根据化学式判断,要根据立体结构判断; 因为H2O2不是平面结构;它是半开书页型的,两个O在书轴上,两个氢分别和两个O相连,但不在同一平面上,正负电荷中心不重合,所以为极性分子。 还可以根据相似相容原理来粗略判断物质极性,H2O2极易溶于水,水是极性分子,所以过氧化氢也是极性分子。 3、键的极性对化学性质的影响 ①键的极性对物质的化学性质有重要影响 羧酸是一大类含羧基(—COOH)的有机酸,羧基可电离出H+而呈酸性。羧酸的酸性可用pKa的大小来衡量,pKa越小,酸性越强。 ②羧基的酸性大小与分子组成和结构的关系 由于不同的成键原子间电负性的差异,共用电子对会发生偏移,若电负性越大,电子偏移的程度就越大,即共价键的极性越强,在反应中越容易断裂。 (1)含卤素原子的一元羧酸的酸性 a、含相同个数的不同卤素原子的羧酸,卤素原子的电负性数值越大,羧酸的酸性越强。 b、含不同数目的同种卤素原子的羧酸,卤素原子的数目越多,羧酸的酸性越强。 (2)只含烷基的一元羧酸,烷基越长,酸性越小 思考:甲酸和乙酸哪个酸性强?原因是什么? 酸性: 甲酸>乙酸 原因是:烷基(R—)是推电子基团,烷基越长推电子效应越大,使羧基中的O-H键的极性减弱,所以羧酸的酸性越弱。 (3)只含烷基的多元羧酸的酸性 烷基所含碳原子数越少,羧基个数越多,酸性越强。 补充知识:吸电子基团与推电子基团(给电子基团) 对于一个基团-RX: (1)如果R的电负性大于X,那么它就是推电子基团(给电子基团) 若分子连有推电子基团,键的极性越弱,越不易断裂 (2)如果R的电负性小于X,那么它就是吸电子基团 若分子连有吸电子基团,键的极性越强,越易断裂 小结: (1)烷基是推电子基团,烷基越长,推电子效应越大,使羧基中的羟基的极性越小,羧酸的酸性越弱。 随着烷基加长,酸性的差异越来越小。 (2)卤素原子是吸电子基团,卤素原子越多,吸电子效应越大,使羧基中的羟基的极性越大,羧酸的酸性越强。 补充:无机含氧酸酸性规律: 1、同一元素若能形成几种不同价态的含氧酸,其酸性依化合价的递增而递增; 2、 (HO)mROn,如果成酸元素R不同时,则非羟基氧原子数n值越大,即酸性越强。注:当n相同时,可参考元素的非金属性,如H2SO3和H2CO3 学生:练习:指出下列微粒中的共价键类型: 1、O2 2 、CH4 3 、CO2 4、 H2O2 5 、Na2O2 6 、NaOH 练习1:CH3CH2OH、H2O分别与钠反应,哪个反应更剧烈?试从键的极性角度解释原因。 练习2、根据下表,分析总结无机含氧酸酸性大小与其分子结构的关系。 练习3、 (1)判断HClO、HClO3、HClO4酸性由弱到强的顺序为________________。 (2)判断H3AsO4、H2CrO4、HMnO4酸性由弱到强的顺序为 _____________________。 (3)已知H3PO3为二元中强酸,H3AsO3为弱酸。试推断H3PO3和H3AsO3的分子
结构____________________。 (4)判断碳酸应属于__________酸,与通常认为的碳酸的强度是否一致? 其可能的原因是___________________________________________。 [设计意图]掌握共价键可分为极性共价键和非极性共价键。区分极性分子和非极性分子,了解分子极性与分子中键的极性及分子空间结构密切相关。掌握键的极性对化学性质的影响,能从分子的结构判断羧酸的酸性大小。 |
板书设计 | 一、键的极性和分子的极性 1、共价键的极性 2、分子的极性 3、键的极性对化学性质的影响 |
课后作业 |
练习册上相关习题。 |
教学反思 | 亮点:在本节课的教学过程中以新课标的教学理念为基础,在充分利用教材的基础上优化课堂教学。本节课主要介绍共价键的极性和分子的极性以及对分子某些性质的影响。用图片展示的方式是相关内容变得直观,学生风容易理解。 课堂教学建议:通过第一章原子结构与性质的学习,学生基本掌握了原子结构的特点,并且能通过价键理论讨论物质的形成过程。本节课从建的极性对化学性质的影响拓展到分子结构对性质的影响,进一步认识物质结构与物质性质的关系。 |
人教版 (2019)选择性必修2第三章 晶体结构与性质第四节 配合物与超分子精品教学设计及反思: 这是一份人教版 (2019)选择性必修2第三章 晶体结构与性质第四节 配合物与超分子精品教学设计及反思,文件包含核心素养人教版高中化学选修二《配合物与超分子》课件pptx、核心素养人教版高中化学选修二《配合物与超分子》教学设计含教学反思docx等2份教案配套教学资源,其中教案共12页, 欢迎下载使用。
人教版 (2019)选择性必修2第三节 分子结构与物质的性质精品第二课时教学设计: 这是一份人教版 (2019)选择性必修2第三节 分子结构与物质的性质精品第二课时教学设计,文件包含核心素养人教版高中化学选修二《分子结构与物质的性质》第二课时课件pptx、核心素养人教版高中化学选修二《分子结构与物质的性质》第二课时教学设计含教学反思docx等2份教案配套教学资源,其中教案共7页, 欢迎下载使用。
化学选择性必修2第二节 分子的空间结构优秀第一课时教案: 这是一份化学选择性必修2第二节 分子的空间结构优秀第一课时教案,文件包含核心素养人教版高中化学选修二《分子的空间结构》第一课时课件pptx、核心素养人教版高中化学选修二《分子的空间结构》第一课时教学设计含教学反思docx等2份教案配套教学资源,其中教案共8页, 欢迎下载使用。














