





人教版 (2019)选择性必修2第三节 分子结构与物质的性质精品第二课时教学设计
展开(人教版高中化学选择性必修2)
《分子结构与物质的性质》第二课时 教学设计
课题名 | 《分子结构与物质的性质》第二课时 |
教材分析 | 本节课介绍了分子间作用力、氢键等概念,以及它们对物质性质的影响,并从分子结构的角度说明了“相似相溶”规则、分子的手性等。结合上一节课键的极性与分子的极性,让学生体会物质结构对性质的影响。 |
核心素养 | 宏观辨识与微观探析:认识分子间存在相互作用,知道范德华力和氢键是两种常见的分子间作用力。掌握分子间作用力(含氢键)对物质物理性质的影响。知道分子的手性对其性质的影响,能判断有机化合物分子是否具有手性。 证据推理与模型认知:能说明分子间作用力(含氢键)对物质熔点沸点等性质的影响,能列举含有氢键的物质及其性质特点,形成氢键影响物质性质的理论模型。 科学探究与创新意识:结合实例认识分子的手性对其性质的影响,能判断有机化合物分子是否具有手性,培养学生关注手性药品、手性材料等的意识。 |
教学重点 | 范德华力和氢键是两种常见的分子间作用力,分子间作用力(含氢键)对物质物理性质的影响。 |
教学难点 | 分子间作用力(含氢键)对物质熔点沸点等性质的影响,能列举含有氢键的物质及其性质特点。 |
教学方法 | 讲解,举例 |
教学准备 | 教师准备:PPT 学生准备:预习课本 |
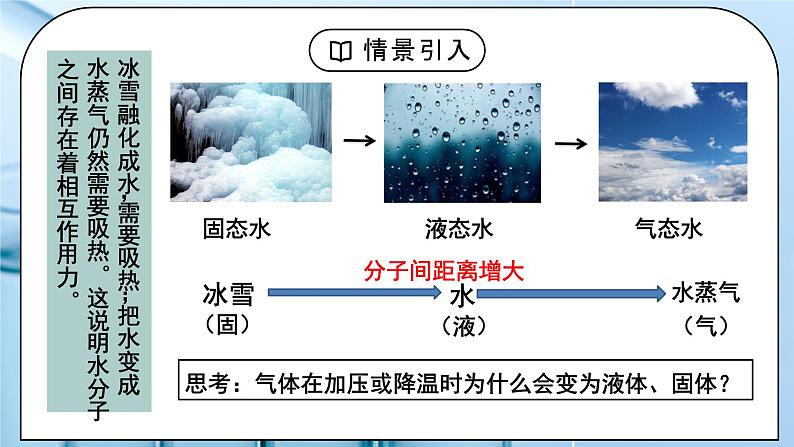
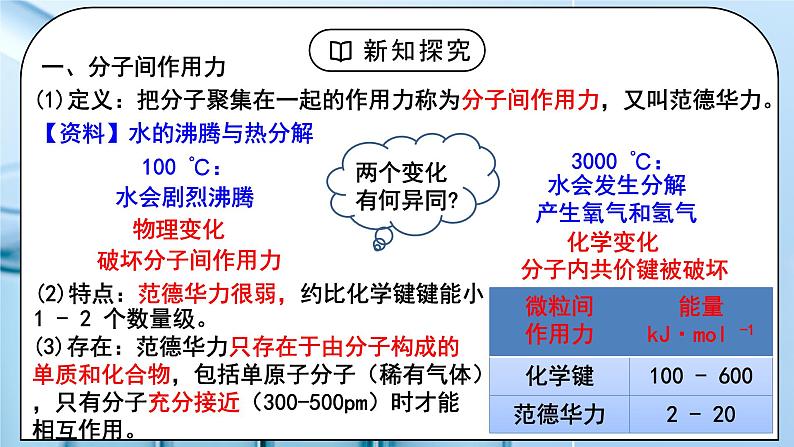
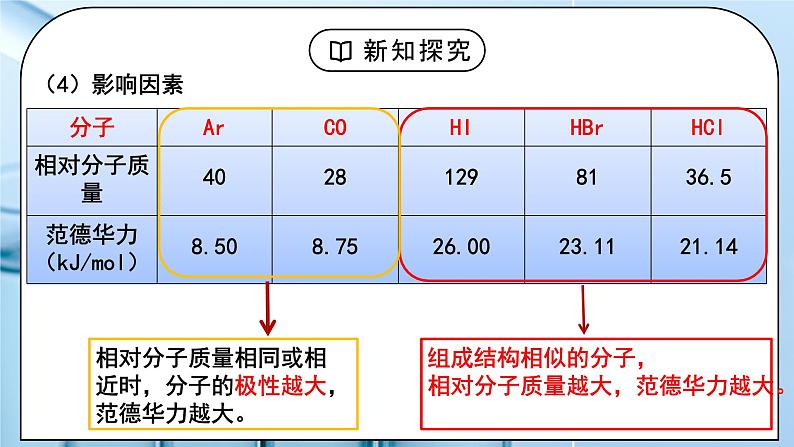
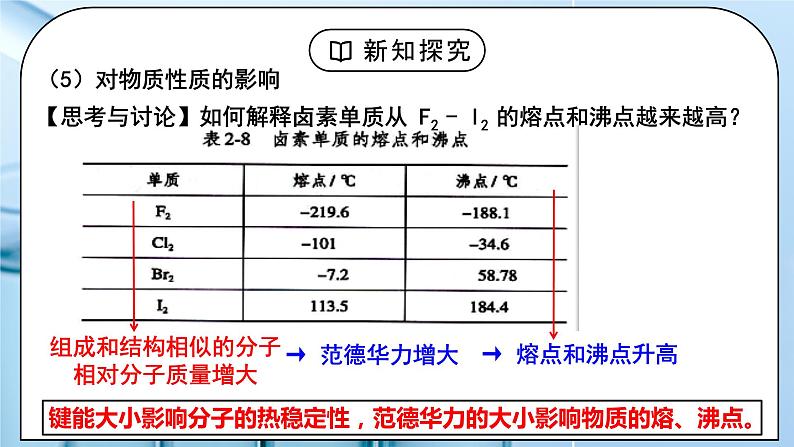
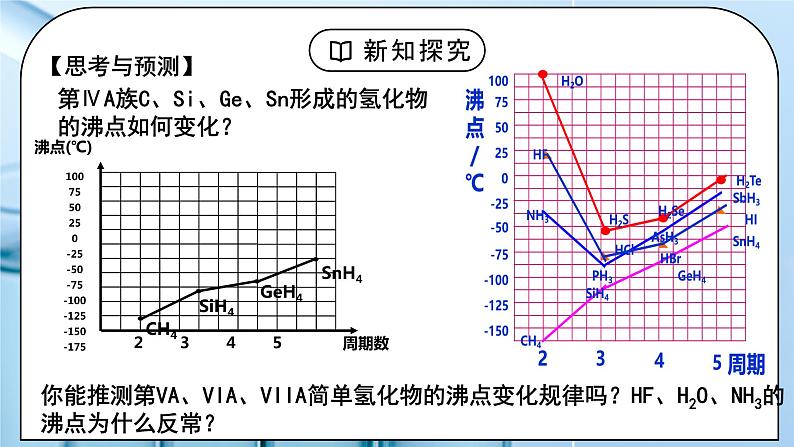
教学过程 | 一、新课导入 1.如何证明水分子之间存在着相互作用力 教师:思考:气体在加压或降温时为什么会变为液体、固体? 冰雪融化成水,需要吸热;把水变成水蒸气仍然需要吸热。这说明水分子之间存在着相互作用力。 学生:思考气体在加压或降温时为什么会变为液体、固体。 [设计意图]通过思考:气体在加压或降温时为什么会变为液体、固体,引入分子间作用力的学习。 二、探究新知 1.分子间作用力及对物质性质的影响 教师: 一、分子间作用力 (1)定义:把分子聚集在一起的作用力称为分子间作用力,又叫范德华力。 【资料】水的沸腾与热分解 (2)特点:范德华力很弱,约比化学键键能小 1 - 2 个数量级。 (3)存在:范德华力只存在于由分子构成的单质和化合物,包括单原子分子(稀有气体),只有分子充分接近(300-500pm)时才能相互作用。 (4)影响因素 相对分子质量相同或相近时,分子的极性越大,范德华力越大。 组成结构相似的分子,相对分子质量越大,范德华力越大。 (5)对物质性质的影响 【思考与讨论】如何解释卤素单质从 F2 - I2 的熔点和沸点越来越高? 组成结构相似的分子,相对分子质量越大,范德华力越大。 键能大小影响分子的热稳定性,范德华力的大小影响物质的熔、沸点。 【思考与预测】 第ⅣA族C、Si、Ge、Sn形成的氢化物的沸点如何变化? 你能推测第VA、VIA、VIIA简单氢化物的沸点变化规律吗?HF、H2O、NH3的沸点为什么反常? 二、氢键: (1)定义:氢键是除范德华力之外的另一种分子间作用力,它不是化学键。它是由已经与电负性很大的原子(如N、F、O)形成共价键的氢原子(如水分子中的氢)与另一分子中电负性很大的原子(如水分子中的氧)之间的作用力。 在水分子的O-H中,共用电子对强烈的偏向O,使得H几乎成为“裸露”的质子,其显正电性,它能与另一个水分子中相对显负电性的O的孤电子对产生静电作用,这种静电作用就是氢键。 (2)本质:是静电吸引作用,不是化学键,而是较强的分子间作用力,其键能比化学键小1-2个数量级,比范德华力强。 (3)表示: 氢键通常用X—H…Y —表示,“—”表示共价键,“…”表示形成的氢键(X、Y为N、O、F),X、Y可以相同,也可以不同 。 (4)氢键强弱: X—H…Y X、Y原子半径小,它们的吸引电子能力越强(即电负性越大),则氢键越强 F-H…F > O-H…O > O-H…N > N-H…N (5)特征: ①方向性(X-H…Y尽可能在同一条直线上,使排斥作用最小,体系能量最低) ②饱和性(一个X-H只能和一个Y原子结合)(水分子间形成多个氢键) (6)分类:分子内氢键和分子间氢键 结论:(1)分子内存在氢键时,物质的熔、沸点将下降。 (2)分子间存在氢键时,物质的熔、沸点将升高。 小结: (7)氢键对物质性质的影响(影响的是物理性质 ) ①氢键对物质熔、沸点的影响 VA~VIA族元素的氢化物中,NH3、H2O和HF的熔沸点比同主族相邻元素氢化物的熔、沸点高,这种反常现象是由于它们各自的分子间形成了氢键。 ②氢键对物质密度的影响 常温下液态水中除了含有简单H2O外,还含有通过氢键联系在一起的缔合分子(H2O)2、(H2O)3……(H2O)n等。一个水分子的氧原子与另一个水分子的氢原子沿该氧原子的一个sp3杂化轨道的方向形成氢键,因此当所有H2O全部缔合——结冰后,所有的H2O按一定的方向全部形成了氢键,成为晶体,因此在冰的结构中形成许多空隙,体积膨胀,密度减小。故冰的体积大于等质量的水的体积,冰的密度小于水的密度。 在水蒸气中水以单个的H2O分子形式存在,故不存在氢键。 ③氢键对物质溶解度的影响 溶质分子与溶剂分子间能形成氢键,则能大大提高溶质的溶解度。如HF、NH3、低级醇、醛、酮等分子都与水分子形成氢键,均可溶于水。 三、溶解性 (1)温度和压强 (2)氢键:溶剂和溶质之间的氢键作用力越大,溶解性越好; (3)相似相溶: ①非极性溶质一般能溶于非极性溶剂,极性溶质一般能溶于极性溶剂 ②“相似相溶”还适用于分子结构的相似性。 【思考与讨论】 (1)比较NH3和CH4在水中的溶解度。怎样用“相似相溶”规律理解它们的溶解度不同? (2)为什么在日常生活中用有机溶剂(如乙酸乙酯等)溶解油漆而不用水? (3)在一个小试管里放入一小粒碘晶体,加入约5 mL蒸馏水,观察碘在水中的溶解性(若有不溶的碘,可将碘水溶液倾倒在另一个试管里继续下面的实验)。在碘水溶液中加入约1 ml CCl4,振荡试管,观察碘被CCl4萃取,形成紫红色的碘的CCl4溶液。再向试管里加入1 ml 浓碘化钾(KI)水溶液,振荡试管,溶液紫色变浅,这是由于在水溶液里可发生如下反应:I2+I- I3-。实验表明碘在纯水还是在CCl4中溶解性较好?为什么? 四、分子的手性 人的左、右手互为实物 和 镜像,但彼此不能重合。 (1)手性异构体 具有完全相同的组成和原子排列的一对分子,犹如实物和镜像,但彼此不能重合,互称手性异构体(或对映异构体)。 (2)手性分子 有手性异构体的分子叫做手性分子。 (3)手性分子的判断方法:有机物分子中是否存在手性碳原子 手性碳原子:连接四个互不相同的原子或基团的碳原子称为手性碳原子。用*C来标记。 学生: 练习1:标出手性碳原子 练习2:下列现象与氢键有关的是 ( ) ①HF的熔、沸点比ⅦA族其他元素氢化物的高 ②乙醇可以和水以任意比互溶 ③冰的密度比液态水的密度小 ④水分子高温下也很稳定 ⑤ 邻羟基苯甲酸的熔、沸点比对羟基苯甲酸的低 A.②③④⑤ B.①②③⑤ C.①②③④ D.①②③④ 练习3:氨气溶于水中,大部分NH3与H2O以氢键(用“…”表示)结合形成NH3·H2O分子。根据氨水的性质可推知NH3·H2O的结构式为( )
A. B. C. D. 练习4:在CO2低压合成甲醇反应(CO2+3H2 = CH3OH+H2O)中,所涉及的4种物质中,沸点从高到低的顺序为_______________________,原因是___________________________________________________。 练习5:元素As与N同族。预测As的氢化物分子的空间结构为__________,其沸点比NH3的____(填“高”或“低”),其判断理由是___________________。 练习6:苯胺与甲苯( ) 的相对分子质量相近,但苯胺的熔点(-5.9 ℃)、沸点(184.4 ℃)分别高于甲苯的熔点(-95.0 ℃)、沸点(110.6 ℃),原因是______________________。 [设计意图]认识分子间存在相互作用,知道范德华力和氢键是两种常见的分子间作用力。掌握分子间作用力(含氢键)对物质物理性质的影响。知道分子的手性对其性质的影响,能判断有机化合物分子是否具有手性。 |
板书设计 | 一、分子间作用力 把分子聚集在一起的作用力称为分子间作用力,又叫范德华力。 键能大小影响分子的热稳定性,范德华力的大小影响物质的熔、沸点。 二、氢键: 氢键是除范德华力之外的另一种分子间作用力,它不是化学键。 三、溶解性 “相似相溶” 四、分子的手性 |
课后作业 |
练习册上相关习题。 |
教学反思 | 亮点:本节课介绍了分子间作用力、氢键等概念,以及它们对物质性质的影响,并从分子结构的角度说明了“相似相溶”规则、分子的手性等。结合上一节课键的极性与分子的极性,让学生体会物质结构对性质的影响。 课堂教学建议:本节课内容较多,教学过程中应结合实例强化分子间作用力、氢键等概念,让学生体会物质结构对物质性质的影响。 |
人教版 (2019)选择性必修2第三章 晶体结构与性质第四节 配合物与超分子精品教学设计及反思: 这是一份人教版 (2019)选择性必修2第三章 晶体结构与性质第四节 配合物与超分子精品教学设计及反思,文件包含核心素养人教版高中化学选修二《配合物与超分子》课件pptx、核心素养人教版高中化学选修二《配合物与超分子》教学设计含教学反思docx等2份教案配套教学资源,其中教案共12页, 欢迎下载使用。
高中化学人教版 (2019)选择性必修2第二节 分子晶体与共价晶体优质第二课时教学设计: 这是一份高中化学人教版 (2019)选择性必修2第二节 分子晶体与共价晶体优质第二课时教学设计,文件包含核心素养人教版高中化学选修二《分子晶体与共价晶体》第二课时课件pptx、核心素养人教版高中化学选修二《分子晶体与共价晶体》第二课时教学设计含教学反思docx等2份教案配套教学资源,其中教案共9页, 欢迎下载使用。
高中化学人教版 (2019)选择性必修2第三节 分子结构与物质的性质获奖第一课时教学设计: 这是一份高中化学人教版 (2019)选择性必修2第三节 分子结构与物质的性质获奖第一课时教学设计,文件包含核心素养人教版高中化学选修二《分子结构与物质的性质》第一课时课件pptx、核心素养人教版高中化学选修二《分子结构与物质的性质》第一课时教学设计含教学反思docx等2份教案配套教学资源,其中教案共7页, 欢迎下载使用。














