

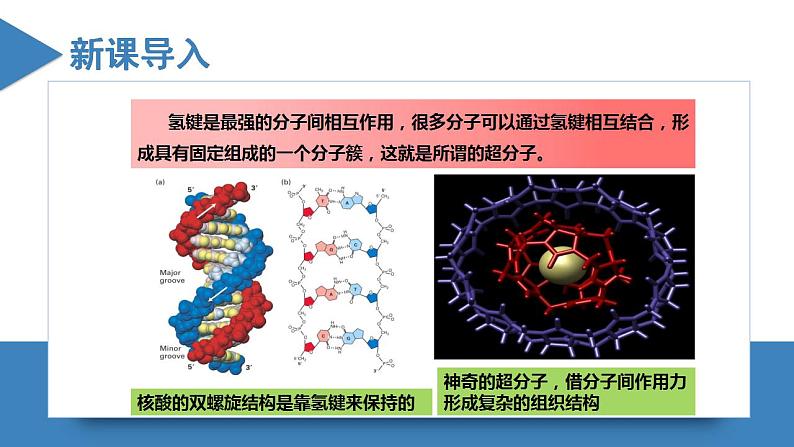



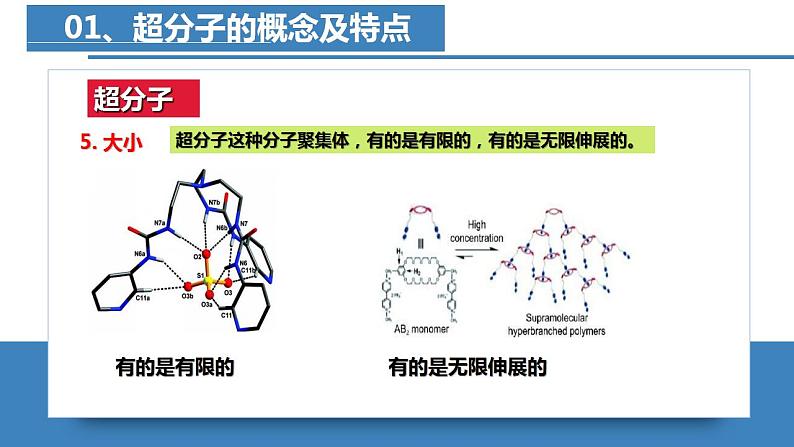



高中化学人教版 (2019)选择性必修2第四节 配合物与超分子一等奖课件ppt
展开第四节 配合物与超分子
课时2
超分子
一、单选题
1.对配合物[Cr(H2O)4Br2]Br·2H2O的说法正确的是
A.配体为水分子,配原子为O,外界为Br-
B.中心离子的配位数为6
C.1mol该配合物可以与足量AgNO3溶液反应生成3molAgBr沉淀
D.中心离子的化合价为+2
2.下列说法中正确的是
A.1个氮气分子中含有1个σ键和2个π键
B.N—O键的键长比C—O键的键长长
C.乙烯中碳碳双键的键能是乙烷中碳碳单键的键能的2倍
D.中4个N—H键的键能不同
3.异黄酮类化合物是药用植物的有效成分。一种异黄酮Z的部分合成路线如图:
下列有关化合物X、Y和Z的说法不正确的是
A.1mol X中含有3mol碳氧σ键 B.Y中含3个手性碳原子
C.Z在水中的溶解度比Y大 D.X、Y、Z遇FeCl3溶液均显色
4.下列物质的图象或有关说法不正确的是
A.水合铜离子的模型如图1,水合铜离子中存在极性共价键、配位键、离子键
B.CaF2晶体的晶胞如图2所示,每个CaF2晶胞平均占有4个Ca2+
C.石墨晶体如图3,既有共价键,又有金属键,还有范德华力,是混合晶体
D.金属铜中Cu原子堆积模型如图4所示,该金属晶体为面心立方最密堆积,配位数为12
5.下列物质中,不能作为配合物的配位体的是
A. B. C. D.
6.下列物质不能作为配合物的配体的是
A.H2O B. C.NH3 D.SCN-
7.下列分子或离子中,能提供孤对电子与某些金属离子形成配位键的是
①H2O ②NH3 ③F- ④CN- ⑤OH-
A.①② B.①②③ C.①②④ D.①②③④⑤
8.下列分子或离子中不能形成配位键的是
A.NH3 B.H2O C.Cu2+ D.
9.一水合甘氨酸锌是一种矿物类饲料添加剂,其结构简式如图所示。下列说法错误的是
A.基态Zn原子价电子排布式为
B.Cu与Zn相邻,第一电离能:
C.该物质中,的配位数为5,配原子为O、N
D.电负性由小到大的顺序为
10.干冰和二氧化硅晶体同属于第IVA族元素的最高价氧化物,它们的熔、沸点差别很大的原因是
A.二氧化硅的相对分子质量大于二氧化碳的相对分子质量
B.C—O的键能比Si—O的键能小
C.干冰为分子晶体,二氧化硅为共价晶体
D.干冰易升华,二氧化硅不易升华
11.下列关于配位化合物的叙述中,不正确的是
A.配位化合物中一定存在配位键
B.配位化合物中只有配位键
C.中的提供空轨道,中的O提供孤电子对形成配位键
D.配位化合物在半导体等尖端技术、医药科学、催化反应和材料化学等领域都有广泛的应用
12.下列物质或微粒中不含配位键的是
A. B. C. D.
13.下列物质中都存在离子键、极性键和配位键的是
A.过氧化钠、硫酸四氨合铜、氢化钠
B.硝酸铵、氢氧化二氨合银、氯化铵
C.氯化氢、氢氧化钠、氢氧化钡
D.氯化铵、过氧化氢、过氧化钙
14.下列关于配位化合物的叙述中不正确的是
A.配位化合物中必定存在配位键
B.有些配位化合物显现出特征的颜色,从而可用于物质的检验
C.中的提供孤电子对,中的N原子提供空轨道,两者结合形成配位键
D.配位化合物在半导体等尖端技术、医学科学、催化反应和材料化学等领域都有广泛的应用
第II卷(非选择题)
请点击修改第II卷的文字说明
二、填空题
15.书写以下要求的表达式:
(1)过氧化钠的电子式_______;
(2)Ga原子核外电子排布式_______;
(3)的原子结构示意图_______;
(4)中心原子B的杂化方式为_______;
(5)分子空间构型为_______;
(6)准确书写向硫酸铜水溶液中滴加氨水至起初产生的沉淀溶解的原理(用离子反应方程式回答)
①_______;
②_______;
16.该化合物中含有H、N、O、S、Cu五种元素,加热时首先失去的组分是_______,判断理由是_______。
17.事实证明熔融态氯化铝可挥发出二聚分子Al2Cl6,其结构如图所示,请在图上用“→”标出其配位键_______
18.[Ag(NH3)2]+中Ag+空的5s轨道和5p轨道以sp杂化成键,则该配离子的空间构型是_______。
19.在配合物中画氢键、配位键 (已知镍的配位数为4) ___________。
Ni2++→+2H+
20.关于[Ti(NH3)5Cl]Cl2的说法中错误的是___________
A.1mol[Ti(NH3)5Cl]Cl2含有σ键的数目为15NA
B.中心原子的化合价为+3价
C.中心原子的配位数是6
21.FeTiO3的结构如图所示,其中由O围成的__(填“四面体空隙”或“八面体空隙”)被Fe占据,Ti的配位数为__。
三、元素或物质推断题
22.A、B、C、D、E、F六种短周期元素,其原子序数依次增大,其中B与C同周期,D与E和F同周期,A与D同主族,C与F同主族,C元素原子的s能级电子总数与p能级的相等,D是所在周期原子半径最大的主族元素。又知六种元素所形成的常见单质在常温常压下有三种是气体,三种是固体。请回答下列问题:
(1)A是_______(填元素符号,下同),B是_______,C是_______,D是_______,F是_______。
(2)C、D、F三种元素形成的简单离子的半径由大到小的顺序是_______(用离子符号表示)。
(3)由A、B、C三种元素以原子个数比4∶2∶3可形成一种离子化合物,其阳离子电子式为_______。
(4)若E是金属元素,其单质与氧化铁反应常用于焊接钢轨,请写出反应的化学方程式:_______。若E是非金属元素,其单质在电子工业中有重要应用,请写出其氧化物溶于强碱溶液的离子方程式:_______。
四、结构与性质
23.钛、铁、铜、钐等过渡金属有着广泛的用途。请回答下列问题:
(1)铁在元素周期表中的位置_______,基态铜原子的核外电子排布式为_______。
(2)配合物常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断晶体属于_______(填晶体类型)。的中心原子价电子数与配体提供电子数之和为18,则n=_______。
(3)]溶液可用于检验_______(填离子符号)。的四卤化物熔点如下表所示,熔点高于其他三种卤化物,自至熔点依次升高,原因是_______。
化合物 | ||||
熔点/C | 377 | -24.12 | 38.3 | 155 |
(4)一种四方结构的超导化合物的晶胞结构如图1所示,晶胞中Sm和As原子的投影位置如图2所示。
图中和共同占据晶胞的上下底面位置,若两者的比例依次用x和1-x代表,则该化合物的化学式表示为_____,通过测定密度和晶胞参数,可以计算该物质的x值,完成它们关系表达式:_______。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图1中原子1的坐标为(,,),则原子2和3的坐标分别为______、_____。
第四节 配合物与超分子
课时2
超分子
一、单选题
1.对配合物[Cr(H2O)4Br2]Br·2H2O的说法正确的是
A.配体为水分子,配原子为O,外界为Br-
B.中心离子的配位数为6
C.1mol该配合物可以与足量AgNO3溶液反应生成3molAgBr沉淀
D.中心离子的化合价为+2
【答案】B
【解析】
【详解】
A.[Cr(H2O)4Br2]Br·2H2O中配体是H2O和Br-,外界为Br-,A项错误;
B.[Cr(H2O)4Br2]Br·2H2O中配体是H2O和Br-,则中心离子的配位数个数为6,B项正确;
C.[Cr(H2O)4Br2]Br·2H2O中配体是H2O和Br-,外界为Br-,则1mol[Cr(H2O)4Br2]Br·2H2O在水溶液中只电离出1mol溴离子,所以1mol该配合物可以与足量AgNO3溶液反应生成1molAgBr沉淀,C项错误;
D.[Cr(H2O)4Br2]Br·2H2O中阴离子是溴离子,溴离子的化合价是-1价,所以铬离子的化合价是+3价,D项错误;
答案选B。
2.下列说法中正确的是
A.1个氮气分子中含有1个σ键和2个π键
B.N—O键的键长比C—O键的键长长
C.乙烯中碳碳双键的键能是乙烷中碳碳单键的键能的2倍
D.中4个N—H键的键能不同
【答案】A
【解析】
【详解】
A.氮气分子的结构式为N≡N,氮氮三键中含有1个σ键和2个π键,故A正确;
B.氮原子的原子半径小于碳原子,则氮氧键的键长小于碳氧键,故B错误;
C.乙烯中碳碳双键的键能大于碳碳单键的键能,但小于碳碳单键的键能的2倍,故C错误;
D.铵根离子中含有3个极性键和1个配位键,但4个氮氢键的键能完全相同,故D错误;
故选A。
3.异黄酮类化合物是药用植物的有效成分。一种异黄酮Z的部分合成路线如图:
下列有关化合物X、Y和Z的说法不正确的是
A.1mol X中含有3mol碳氧σ键 B.Y中含3个手性碳原子
C.Z在水中的溶解度比Y大 D.X、Y、Z遇FeCl3溶液均显色
【答案】B
【解析】
【详解】
A.碳氧单键为σ键,碳氧双键中有1个σ键和1个π键,由结构简式可知,1mol X中含有3mol碳氧σ键,A正确;
B.手性碳原子为连有4个不同基团或原子的饱和碳原子,Y中不含有手性碳原子,B错误;
C.由结构简式可知,与Y分子相比,Z分子中除含有酚羟基外,还含有亲水基羧基,则Z在水中的溶解度比Y大,C正确;
D.由结构简式可知,X、Y、Z三种分子中都含有酚羟基,遇氯化铁溶液都能显紫色,D正确;
答案选B。
4.下列物质的图象或有关说法不正确的是
A.水合铜离子的模型如图1,水合铜离子中存在极性共价键、配位键、离子键
B.CaF2晶体的晶胞如图2所示,每个CaF2晶胞平均占有4个Ca2+
C.石墨晶体如图3,既有共价键,又有金属键,还有范德华力,是混合晶体
D.金属铜中Cu原子堆积模型如图4所示,该金属晶体为面心立方最密堆积,配位数为12
【答案】A
【解析】
【详解】
A.水合铜离子的模型如图1,水合铜离子中存在极性共价键、配位键,没有离子键,故A错误;
B.CaF2晶体的晶胞如图2所示,每个CaF2晶胞平均占有个Ca2+,故B正确;
C.如图3,石墨晶体是混合晶体,既有共价键,又有金属键,还有范德华力,故C正确;
D.如图4是金属铜晶体,金属铜晶体为面心立方最密堆积,配位数为12,故D正确。
综上所述,答案为A。
5.下列物质中,不能作为配合物的配位体的是
A. B. C. D.
【答案】C
【解析】
【分析】
【详解】
A.中N原子有孤电子对,可以作为配合物的配体,A不符合题意;
B.中N原子有孤电子对,可以作为配合物的配体,B不符合题意;
C.中N、H原子均没有孤电子对,不能作为配体,C符合题意;
D.NH3中N原子有孤电子对,可以作为配合物的配体,D不符合题意;
综上所述答案为C。
6.下列物质不能作为配合物的配体的是
A.H2O B. C.NH3 D.SCN-
【答案】B
【解析】
【分析】
【详解】
A.H2O中O原子孤电子对,可以作为配合物的配体,A不符合题意;
B.NH中N、H原子均没有孤电子对,不能作为配体,B符合题意;
C.NH3中N原子有孤电子对,可以作为配合物的配体,C不符合题意;
D.SCN-中S、N原子均含有孤电子对,可以作为配合物的配体,D不符合题意;
综上所述答案为B。
7.下列分子或离子中,能提供孤对电子与某些金属离子形成配位键的是
①H2O ②NH3 ③F- ④CN- ⑤OH-
A.①② B.①②③ C.①②④ D.①②③④⑤
【答案】D
【解析】
【分析】
【详解】
①水分子中的O原子有孤电子对,可以提供孤对电子与某些金属离子形成配位键,①符合题意;
②NH3分子中N原子有孤电子对,可以提供孤对电子与某些金属离子形成配位键,②符合题意;
③F-含有孤电子对,可以提供孤对电子与某些金属离子形成配位键,③符合题意;
④CN-中C、N原子均有孤电子对,C原子电负性较小,更易给出电子,与与某些金属离子形成配位键,④符合题意;
⑤OH-中O原子有孤电子对,可以提供孤对电子与某些金属离子形成配位键,⑤符合题意;
综上所述答案为D。
8.下列分子或离子中不能形成配位键的是
A.NH3 B.H2O C.Cu2+ D.
【答案】D
【解析】
【分析】
含有孤电子对和含有空轨道的原子之间能形成配位键。
【详解】
A.氨气分子中氮原子含有孤对电子,能形成配位键,故A不选;
B.水分子中O原子含有孤对电子,能形成配位键,故B不选;
C.Cu2+中含有空轨道,能形成配位键,故C不选;
D.中原子不含有孤对电子,也不含有空轨道,不能形成配位键,故选D;
答案选D。
9.一水合甘氨酸锌是一种矿物类饲料添加剂,其结构简式如图所示。下列说法错误的是
A.基态Zn原子价电子排布式为
B.Cu与Zn相邻,第一电离能:
C.该物质中,的配位数为5,配原子为O、N
D.电负性由小到大的顺序为
【答案】B
【解析】
【分析】
【详解】
A.锌原子的核外电子数为30,其位于元素周期表第4周期第ⅡB,基态Zn原子价电子排布式为,A正确;
B.锌与29号铜相邻,由于锌原子的所有排布电子的原子轨道均处于较稳定的全充满状态,故其第一电离能大于铜的,B错误;
C.由一水合甘氨酸锌的分子结构可知,锌离子与相邻的5个原子(N和O)成键,故其配位数为5,配位原子为O、N,C正确;
D.根据电负性的变化规律可知,非金属元素的电负性大于金属元素,非金属性越强其电负性越大,因此,由小到大的顺序为,D正确;
故选B。
10.干冰和二氧化硅晶体同属于第IVA族元素的最高价氧化物,它们的熔、沸点差别很大的原因是
A.二氧化硅的相对分子质量大于二氧化碳的相对分子质量
B.C—O的键能比Si—O的键能小
C.干冰为分子晶体,二氧化硅为共价晶体
D.干冰易升华,二氧化硅不易升华
【答案】C
【解析】
【详解】
干冰和二氧化硅晶体尽管同属于第VA族元素的最高价氧化物,但干冰是分子晶体,二氧化硅为共价晶体,干冰的熔、沸点高低取决于其分子间作用力的强弱,而不是共价键键能的大小,而二氧化硅的熔、沸点则由键能决定,故C正确;
故选:C。
11.下列关于配位化合物的叙述中,不正确的是
A.配位化合物中一定存在配位键
B.配位化合物中只有配位键
C.中的提供空轨道,中的O提供孤电子对形成配位键
D.配位化合物在半导体等尖端技术、医药科学、催化反应和材料化学等领域都有广泛的应用
【答案】B
【解析】
【详解】
A.配位化合物中一定含有配位键,但也可能含有其他化学键,A项正确,
B.配位化合物可能含有其他化学键,B项错误;
C.有空轨道,中O有孤电子对,可以形成配位键,C项正确;
D.配位化合物应用领域特别广泛,D选项中提到的几个领域都在其应用范围内,D项正确。
故选:B。
12.下列物质或微粒中不含配位键的是
A. B. C. D.
【答案】D
【解析】
【详解】
A.中的化学键含1个配位键,A错误;
B.中的化学键含1个配位键,B错误;
C.中的化学键含2个配位键,C错误;
D.中没有配位键,D正确。
故选:D。
13.下列物质中都存在离子键、极性键和配位键的是
A.过氧化钠、硫酸四氨合铜、氢化钠
B.硝酸铵、氢氧化二氨合银、氯化铵
C.氯化氢、氢氧化钠、氢氧化钡
D.氯化铵、过氧化氢、过氧化钙
【答案】B
【解析】
【详解】
A.中含离子键和非极性键,中含离子键、极性键和配位键,中只含离子键,A错误;
B.三种物质中都含离子键、极性键和配位键,B正确;
C.中含极性键,中含离子键和极性键,中含离子键和极性键,C错误;
D.中含离子键、极性键和配位键,中含极性键和非极性键,中含离子键和非极性键,D错误。
故选:B。
14.下列关于配位化合物的叙述中不正确的是
A.配位化合物中必定存在配位键
B.有些配位化合物显现出特征的颜色,从而可用于物质的检验
C.中的提供孤电子对,中的N原子提供空轨道,两者结合形成配位键
D.配位化合物在半导体等尖端技术、医学科学、催化反应和材料化学等领域都有广泛的应用
【答案】C
【解析】
【详解】
A.配位化合物中一定含有配位键,但也含有其他化学键,A正确;
B.与形成的配合物呈血红色,可用检验,B正确;
C.提供空轨道,中的N原子提供孤电子对,两者结合形成配位键,C错误;
D.配位化合物在半导体等尖端技术、医学科学、催化反应和材料化学等领域都有广泛的应用,D正确;
故选C。
第II卷(非选择题)
请点击修改第II卷的文字说明
二、填空题
15.书写以下要求的表达式:
(1)过氧化钠的电子式_______;
(2)Ga原子核外电子排布式_______;
(3)的原子结构示意图_______;
(4)中心原子B的杂化方式为_______;
(5)分子空间构型为_______;
(6)准确书写向硫酸铜水溶液中滴加氨水至起初产生的沉淀溶解的原理(用离子反应方程式回答)
①_______;
②_______;
【答案】(1)
(2)[Ar]3d104s24p1
(3)
(4)sp3
(5)正四面体
(6) Cu2++2NH3∙H2O=Cu(OH)2↓+2 Cu(OH)2+4NH3∙H2O=[Cu(NH3)4]2++4H2O+2OH-
【解析】
(1)
过氧化钠中有两个钠离子和一个过氧根离子,其电子式;故答案为:;
(2)
Ga是31号元素,则Ga原子核外电子排布式[Ar]3d104s24p1;故答案为:[Ar]3d104s24p1;
(3)
Mn为25号元素,Mn基态原子核外电子排布式[Ar]3d54s2;则的原子结构示意图;故答案为:;
(4)
中心原子B价层电子对数为,则B的杂化方式为sp3;故答案为:sp3;
(5)
中碳原子价层电子对数为4+0=4,则甲烷分子空间构型为正四面体;故答案为:正四面体;
(6)
①向硫酸铜水溶液中滴加氨水,先生成蓝色沉淀即发生的离子方程式为Cu2++2NH3∙H2O=Cu(OH)2↓+2;故答案为:Cu2++2NH3∙H2O=Cu(OH)2↓+2;
②向蓝色沉淀中继续滴加氨水,沉淀不断溶解,则离子反应方程式为Cu(OH)2+4NH3∙H2O=[Cu(NH3)4]2++4H2O+2OH-;故答案为:Cu(OH)2+4NH3∙H2O=[Cu(NH3)4]2++4H2O+2OH-。
16.该化合物中含有H、N、O、S、Cu五种元素,加热时首先失去的组分是_______,判断理由是_______。
【答案】 H2O H2O与Cu2+的配位键比NH3与Cu2+的弱
【解析】
【详解】
阳离子中有两种配位键,因为O原子的电负性大于N原子,故NH3与Cu2+形成的配位键强于H2O与Cu2+形成的配位键,所以加热时先失去H2O。故答案为:H2O与Cu2+的配位键比NH3与Cu2+的弱。
17.事实证明熔融态氯化铝可挥发出二聚分子Al2Cl6,其结构如图所示,请在图上用“→”标出其配位键_______
【答案】
【解析】
【详解】
在AlCl3中Al原子形成3个σ键,L能层还有一个空轨道,Cl原子形成一个σ键,还有3对孤电子对,所以在二聚分子中,形成两个σ键的Cl原子应是和Al原子形成配位键,即。
18.[Ag(NH3)2]+中Ag+空的5s轨道和5p轨道以sp杂化成键,则该配离子的空间构型是_______。
【答案】直线形
【解析】
【详解】
[Ag(NH3)2]+中Ag+空的5s轨道和5p轨道以sp杂化成键,说明该配离子的空间构型是直线形。
19.在配合物中画氢键、配位键 (已知镍的配位数为4) ___________。
Ni2++→+2H+
【答案】
【解析】
【详解】
氢原子与电负性大的原子X以共价键结合,若与电负性大、半径小的原子Y(O、 F 、N等)接近,在X与Y之间以氢为媒介,生成X-H…Y形式的一种特殊的分子间或分子内相互作用,称为氢键,配位键,又称配位共价键,或简称配键,是一种特殊的共价键。当共价键中共用的电子对是由其中一原子独自供应,另一原子提供空轨道时,就形成配位键,故Ni2+含有空轨道,N原子含有孤对电子对,N原子与Ni2+形成配位键,不同分子中氧原子与氢原子之间形成氢键,如图所示:,故答案为:。
20.关于[Ti(NH3)5Cl]Cl2的说法中错误的是___________
A.1mol[Ti(NH3)5Cl]Cl2含有σ键的数目为15NA
B.中心原子的化合价为+3价
C.中心原子的配位数是6
【答案】A
【解析】
【详解】
A.已知单键都是σ键,1个NH3中有3个σ键,而NH3、Cl-与Ti3+之间的配位键也是σ键,故1 mol[Ti(NH3)5Cl]Cl2含有σ键的数目为5×3NA+6NA=21NA,A错误;
B.根据NH3不带电,Cl-为-1价,故中心原子Ti的化合价为+3价,B正确;
C.每个NH3只有一对孤电子对,Cl-与Ti3+形成一对共用电子,故中心原子的配位数是6,C正确;
故答案为:A。
21.FeTiO3的结构如图所示,其中由O围成的__(填“四面体空隙”或“八面体空隙”)被Fe占据,Ti的配位数为__。
【答案】 八面体空隙 12
【解析】
【详解】
根据FeTiO3的结构图可知,O原子位于晶胞的六个面心上,所以由O围成的结构属于八面体空隙;由氧原子围成的八面体的空隙被铁原子占据,距离每个顶点上的钛原子距离最近的O原子为该顶点距离最近的面心上的氧原子,所以Ti的配位数为 ;故答案:八面体空隙;12。
三、元素或物质推断题
22.A、B、C、D、E、F六种短周期元素,其原子序数依次增大,其中B与C同周期,D与E和F同周期,A与D同主族,C与F同主族,C元素原子的s能级电子总数与p能级的相等,D是所在周期原子半径最大的主族元素。又知六种元素所形成的常见单质在常温常压下有三种是气体,三种是固体。请回答下列问题:
(1)A是_______(填元素符号,下同),B是_______,C是_______,D是_______,F是_______。
(2)C、D、F三种元素形成的简单离子的半径由大到小的顺序是_______(用离子符号表示)。
(3)由A、B、C三种元素以原子个数比4∶2∶3可形成一种离子化合物,其阳离子电子式为_______。
(4)若E是金属元素,其单质与氧化铁反应常用于焊接钢轨,请写出反应的化学方程式:_______。若E是非金属元素,其单质在电子工业中有重要应用,请写出其氧化物溶于强碱溶液的离子方程式:_______。
【答案】(1) H N O Na S
(2)S2-> O2-> Na+
(3)
(4)
【解析】
【分析】
C元素原子的s能级电子总数与p能级的相等,且是短周期元素,所以C是O元素,C与F同主族,且是短周期元素,所以F是S元素,D与E和F同周期,都处于第三周期,且D是所在周期原子半径最大的主族元素,所以D是Na元素,E的原子序数大于钠小于硫,所以E的单质是固体,六种元素所形成的常见单质在常 温常压下有三种是气体,三种是固体,B的原子序数小于C,且B、C处于同一周期,所以B是N元素,A的单质是气体,则A的原子序数最小,所以A是H元素,根据元素周期律及其性质解答。
(1)
由分析可知A是H;B是N;C是O;D是Na;F是S;
(2)
C、D、F三种元素形成的简单离子分别是O2-、Na+、S2-,其中氧离子和钠离子的核外电子排布相同,氧离子的原子序数小半径大,硫离子电子层数多,半径最大,故答案为:S2-> O2-> Na+;
(3)
由A、B、C三种元素以原子个数比4:2:3形成化合物X为NH4NO3,阳离子是铵根离子,其电子式为:;
(4)
若E是金属元素,则为Al元素,铝和氧化铁能发生铝热反应,反应方程式为:,若E是非金属元素,其单质在电子工业中有重要应用,则E是Si元素,二氧化硅和强碱反应生成硅酸盐和水,离子反应方程式为: 。
四、结构与性质
23.钛、铁、铜、钐等过渡金属有着广泛的用途。请回答下列问题:
(1)铁在元素周期表中的位置_______,基态铜原子的核外电子排布式为_______。
(2)配合物常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断晶体属于_______(填晶体类型)。的中心原子价电子数与配体提供电子数之和为18,则n=_______。
(3)]溶液可用于检验_______(填离子符号)。的四卤化物熔点如下表所示,熔点高于其他三种卤化物,自至熔点依次升高,原因是_______。
化合物 | ||||
熔点/C | 377 | -24.12 | 38.3 | 155 |
(4)一种四方结构的超导化合物的晶胞结构如图1所示,晶胞中Sm和As原子的投影位置如图2所示。
图中和共同占据晶胞的上下底面位置,若两者的比例依次用x和1-x代表,则该化合物的化学式表示为_____,通过测定密度和晶胞参数,可以计算该物质的x值,完成它们关系表达式:_______。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图1中原子1的坐标为(,,),则原子2和3的坐标分别为______、_____。
【答案】(1) 第4周期Ⅷ族 或者
(2) 分子晶体 5
(3) Fe2+ TiF4为离子化合物,离子之间以离子键结合,离子键是一种强烈的相互作用力,因此物质的熔点高;而其他三种均为共价化合物,是由分子通过分子间作用力结合形成的分子晶体,随着相对分子质量的增大,分子间作用力增大,导致物质熔点逐渐升高
(4) SmFeAsO1-xFx
【解析】
(1)
铁为26号元素,铁元素位于第4周期Ⅷ族,Cu为29号元素,原子核外有29个电子,其基态原子的核外电子排布式为或者;
(2)
配合物熔点较低,易溶于非极性溶剂,属于分子晶体;Fe原子价电子数为8,CO提供一对孤对电子,与Fe原子形成配位键,则8+2n=18, 则n=5;
(3)
和Fe2+会生成蓝色沉淀,故可以检验Fe2+;根据表格数据可知,TiF4 的熔点高于其它三种卤化物的熔点,自TiCl4至TiI4熔点依次升高,这是由于TiF4为离子化合物,离子之间以离子键结合,离子键是一种强烈的相互作用力,因此物质的熔点高;而其他三种均为共价化合物,是由分子通过分子间作用力结合形成的分子晶体,随着相对分子质量的增大,分子间作用力增大,导致物质熔点逐渐升高;
(4)
该晶胞中,As原子个数=4×=2、Sm原子个数=4×=2、Fe原子个数=1+4×=2、F-和O2-离子总数=8×+2×0.5=2,则该晶胞中As、Sm、Fe原子数目与F-和O2-离子总数个数之比=2:2:2:2=1:1:1:1,如果F-个数为x,则O2-个数为1-x,所以该化合物化学式为SmFeAsO1-xFx;根据密度的定义,可知晶体的密度;
由晶胞图可知,若原子1的坐标为(),则原子2是原子1在晶胞的底部投影,x、y的坐标相同,z坐标为0,即;原子3与原子1在同一个平面上,z坐标与原子1相同,x、y坐标为0,即;故答案为:SmFeAsO1-xFx;;
化学选择性必修2第四节 配合物与超分子课文内容课件ppt: 这是一份化学选择性必修2<a href="/hx/tb_c4002454_t3/?tag_id=26" target="_blank">第四节 配合物与超分子课文内容课件ppt</a>,共13页。PPT课件主要包含了情境导入,什么是超分子呢,目标超分子,静电作用,范德华力,超分子的大小,有的是有限的,有的是无限伸展的,分子识别,超分子的特征等内容,欢迎下载使用。
高中化学人教版 (2019)选择性必修2第四节 配合物与超分子优秀课件ppt: 这是一份高中化学人教版 (2019)选择性必修2第四节 配合物与超分子优秀课件ppt,共32页。PPT课件主要包含了空轨道,孤电子对,sp2等内容,欢迎下载使用。
高中化学人教版 (2019)选择性必修2第三章 晶体结构与性质第四节 配合物与超分子精品习题课件ppt: 这是一份高中化学人教版 (2019)选择性必修2第三章 晶体结构与性质第四节 配合物与超分子精品习题课件ppt,共22页。PPT课件主要包含了超分子的概念及特点,超分子,结构特点,认识“杯酚”,超分子方面的诺贝尔奖,工匠精神,超分子的未来发展,课堂小结等内容,欢迎下载使用。













