






人教版 (2019)选择性必修2第三节 金属晶体与离子晶体精品第二课时教案
展开宏观辨识与微观探析: 知道介于典型晶体之间的过渡晶体以及混合型晶体是普遍存在的,知道晶体中粒子间的各种相互作用,比较四类典型晶体的构成粒子,粒子的相互作用与物质性质的关系。证据推理与模型认知: 通过对常见晶体模型的认识,理解晶体的结构特点,预测其性质。科学探究与创新意识: 知道化学学科研究的前沿学科过渡晶体以及混合型晶体,体会新型材料给生活带来的改变。
1.知道介于典型晶体之间的过渡晶体以及混合型晶体是普遍存在的。2.知道晶体中粒子间的各种相互作用,比较四类典型晶体的构成粒子,粒子的相互作用与物质性质的关系。重点:混合型晶体的结构分析及其性质的关系。难点:过渡型晶体和混合型晶体的结构特点和性质的关系。
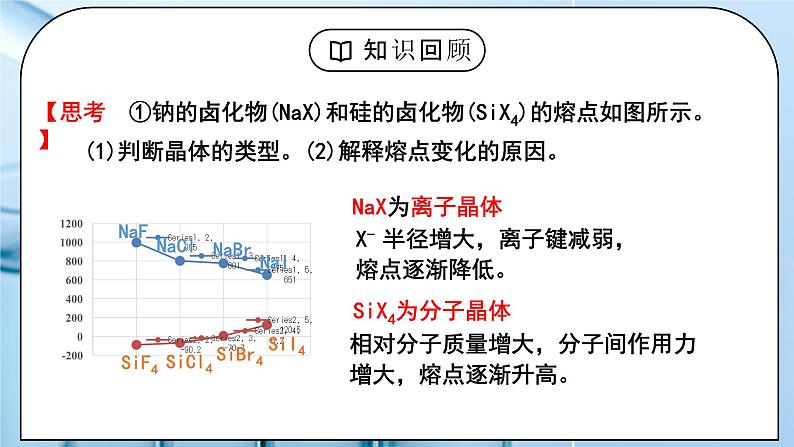
①钠的卤化物(NaX)和硅的卤化物(SiX4)的熔点如图所示。
X- 半径增大,离子键减弱,熔点逐渐降低。
相对分子质量增大,分子间作用力增大,熔点逐渐升高。
(1)判断晶体的类型。(2)解释熔点变化的原因。
②TiF4熔点高于TiCl4 、TiBr4、TiI4 ,自TiCl4至TiI4熔点依次升高,请解释原因。
(1)TiF4是离子化合物,熔点较高
(2)TiCl4、TiBr4、TiI4是共价化合物
事实上,大多数离子晶体中的化学键具有一定的共价键成分。
→相同类型的化合物,为什么有上述情况呢?
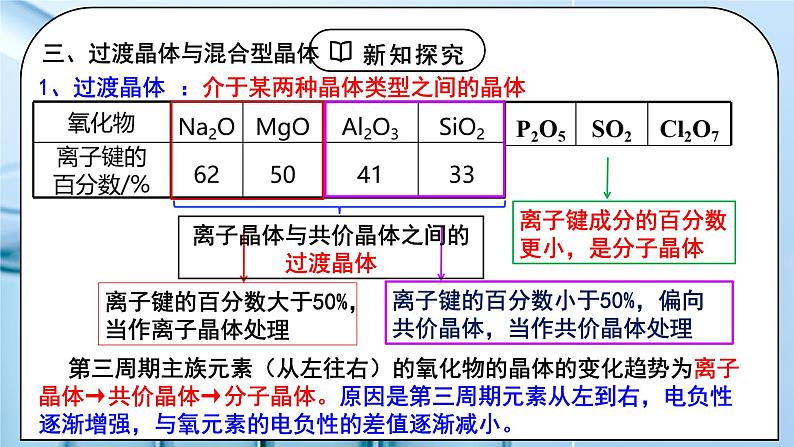
三、过渡晶体与混合型晶体
:介于某两种晶体类型之间的晶体
第三周期主族元素(从左往右)的氧化物的晶体的变化趋势为离子晶体→共价晶体→分子晶体。原因是第三周期元素从左到右,电负性逐渐增强,与氧元素的电负性的差值逐渐减小。
离子晶体与共价晶体之间的过渡晶体
典型的晶体有分子晶体、离子晶体、共价晶体和金属晶体。事实上,纯粹的晶体类型是不多的,大多数晶体是它们之间的过渡晶体。
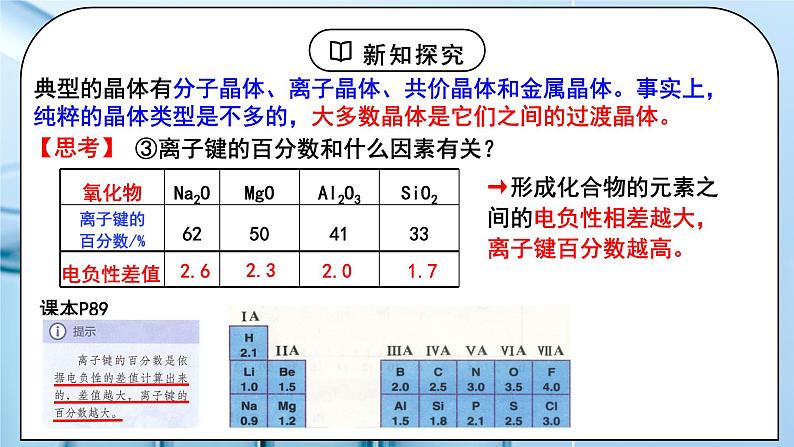
③离子键的百分数和什么因素有关?
→形成化合物的元素之间的电负性相差越大,离子键百分数越高。
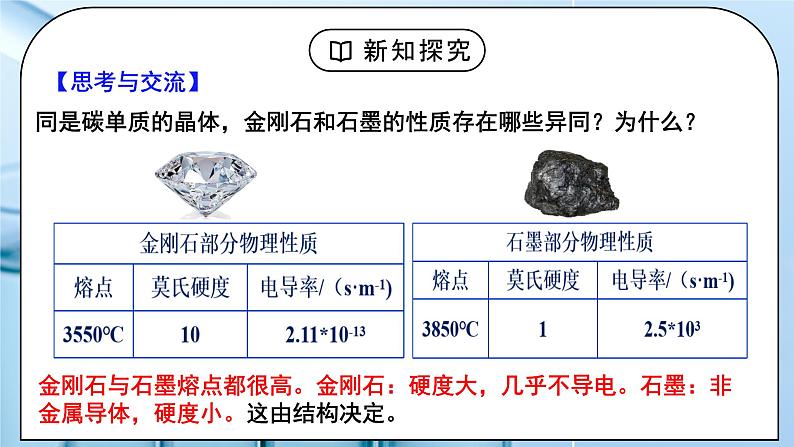
同是碳单质的晶体,金刚石和石墨的性质存在哪些异同?为什么?
金刚石与石墨熔点都很高。金刚石:硬度大,几乎不导电。石墨:非金属导体,硬度小。这由结构决定。
①石墨所有碳原子均采取___杂化,形成_____________结构。金刚石碳原子均采取___杂化,形成________结构
②石墨结构最小__元环。分摊碳原子数____碳碳键数___金刚石结构最小__元环,分摊碳原子数____碳碳键数___质量相同的金刚石与石墨,两者碳碳键的个数比为_____
③石墨中每个C配位数是___金刚石中每个C配位数是___
问题1:比较石墨与金刚石的结构异同?
石墨晶体是层状结构,金刚石是空间网状结构。石墨层内的碳原子核间距为142pm,层间距离为335pm,说明层间没有化学键相连,是靠范德华力维系的,容易滑动所以石墨质软。金刚石碳原子核间距为155pm,键长比石墨长,键能小,所以比石墨的熔点低。
问题2:为什么石墨比金刚石质软但熔点高?
键长:金刚石>石墨 熔点:金刚石<石墨 稳定性:金刚石<石墨
石墨层中每个碳原子均剩余一个未参与杂化的含1个电子的p轨道,所有的p轨道平行重叠,形成离域π键,这些p轨道中的电子可在整个层平面中运动。因此石墨有类似金属晶体的导电性。由于相邻碳原子平面之间相隔较远,电子不能从一个平面跳跃到另一个平面。所以石墨的导电性只能沿石墨平面方向。
问题3:为什么石墨能导电?
未参与杂化的轨道上的电子可在层内运动
像石墨这样的晶体既有共价键又有范德华力,同时还存在类似金属键的作用力,兼具共价晶体、分子晶体、金属晶体特征的晶体,称为混合型晶体。
练习1、已知六方氮化硼类似于石墨的结构,如图所示。
①六方氮化硼的化学式_____,
②六方氮化硼中N和B的杂化类型_____,
③硼与氮之间的化学键为 ,层与层之间作用力为 ,属于的晶体类型 ,
④六方氮化硼虽然类似于石墨结构,但是不导电,其原因是__________________________________________。
六方氮化硼晶体结构其层结构中没有自由电子
⑤六方氮化硼熔点 ,硬度 。
较高
练习2、已知立方氮化硼类似于金刚石的结构,如图所示。
①立方氮化硼中N和B的杂化类型:
②晶胞中N、B的原子数分别是 :
③立方氮化硼熔点 ,硬度 。
较高
④氮化硼和磷化硼都是高温结构陶瓷,但氮化硼晶体的熔点要比磷化硼晶体高,其原因是:
磷化硼和氮化硼都属于原子晶体,而氮原子的半径比磷原子小,B-N共价键键长比B-P键短,键能大,所以氮化硼晶体的熔点较高。
硅酸盐是地壳岩石的主要成分。硅酸盐的阴离子结构丰富多样
①纳米晶体是晶体颗粒尺寸在纳米(10-9m)量级的晶体。在声、光、电、磁、热等性能上常会呈现新的特性。
②金属铅晶体的熔点3280C。但纳米铅晶体大小与熔点的关系如图
由此可见,晶体颗粒小于200 nm 时,晶粒越小,金属铅的熔点越低。
③ 纳米晶体为什么会有不同于大块晶体的特性呢?主要原因是晶体的表面积增大
我们通常说纯物质有固定的熔点,但当纯物质晶体的颗粒小于200 nm (或者250 nm )时,其熔点会发生变化。
【结果与讨论】(1)你是否得到了完美的明矶晶体?请描述你制备的明矾晶体颜色和外形。
能得到明矾晶体,但要得到完美的明矾晶体是比较困难的。颜色:无色透明;外形:块状,有平滑的晶面与棱角。
(2)在上述实验中,为什么所用仪器都要用蒸馏水洗净?为什么晶种一定要悬挂在溶液的中央位置?
仪器用蒸馏水洗净,是防止杂质影响结晶的纯度,也会影响结晶的速率与形状。晶种悬挂在溶液中央位置,有利于离子对称地扩散、溶角解与结晶,有利于获得外形对称性较好的晶体。离杯底太近,会与沉底晶体生长在一起,离液面太近或者杯壁太近,也会造成同样结果,使晶体形状不规则。
称取约60g明矾,量取60mL蒸馏水,倒入100mL烧杯中,将明矾溶解于水,边搅拌边加热,加热到90℃。选择晶形规则的晶体作为晶种,用棉线拴住,待溶液温度约下降5~6℃,再将其吊在上方,使得晶体处于溶液中的中心位置。30min后,就会很明显地观察到约有1cm3大小的规则的八面体结构的明矾晶体出现。且在此过程中,每隔几分钟,就可以观察到晶体大小的明显变化。
(3)在上述实验中,制备明矾大晶体所需时间较长。请查阅资料,并制订快速制备明矾大晶体的实验方案。
【规律方法】1、判断晶体类型的方法
④金属单质或合金在固态时都为金属晶体。
③有很高熔、沸点,硬度大,并且难溶于水的物质大多为原子晶体, 如晶体硅、二氧化硅、金刚石等。
②在熔融状态下能导电的晶体(化合物)是离子晶体。 如NaCl熔融后电离出Na+和Cl-,能自由移动,所以能导电。
①在常温下呈气态或液态或易升华的物质应属于分子晶体(Hg除外)。如H2O、H2、稀有气体等。
一般是根据物质的物理性质:
一般情况下,固体>液体>气体
(2)其次看物质所属晶体类型
一般情况下,共价晶体>离子晶体>分子晶体。金属晶体的熔、沸点差别很大,如钨、铂等金属的熔、沸点很高,汞、铯等金属的熔、沸点很低。
2、物质熔点、沸点高低的比较
(3)同种类型晶体的熔、沸点的比较
分子晶体:①看是否含有氢键:有分子间氢键的熔沸点高,相同的分子间氢键,看氢键的个数,个数越多,熔沸点越高②比较范德华力:组成和结构相似,相对分子质量越大,熔沸点越高③比较分子极性:相对分子质量相近,分子极性越大,熔沸点越高④同分异构体的支链越多,熔、沸点越低。
共价晶体:①晶体的熔、沸点高低取决于共价键的键长和键能。键长越短,键能越大,共价键越稳定,物质的熔、沸点越高。②若没有告知键长或键能数据时,可比较原子半径的大小。一般原子半径越小,键长越短,键能越大,晶体的熔点就越高。
金属晶体:①金属离子半径越小,离子所带电荷数越多,其金属键越强,金属的熔、沸点越高②合金的熔点比组成合金的纯金属低。
离子晶体:①一般地,离子所带的电荷数越多,离子半径越小,则离子间的作用力就越强,其离子晶体的熔、沸点就越高②离子所带的电荷数的影响大于离子半径的影响。
高中化学人教版 (2019)选择性必修2第三节 金属晶体与离子晶体优质第一课时教案: 这是一份高中化学人教版 (2019)选择性必修2第三节 金属晶体与离子晶体优质第一课时教案,文件包含核心素养人教版高中化学选修二《金属晶体与离子晶体》第一课时课件pptx、核心素养人教版高中化学选修二《金属晶体与离子晶体》第一课时教学设计含教学反思docx等2份教案配套教学资源,其中教案共10页, 欢迎下载使用。
人教版 (2019)选择性必修2第三章 晶体结构与性质第四节 配合物与超分子精品教学设计及反思: 这是一份人教版 (2019)选择性必修2第三章 晶体结构与性质第四节 配合物与超分子精品教学设计及反思,文件包含核心素养人教版高中化学选修二《配合物与超分子》课件pptx、核心素养人教版高中化学选修二《配合物与超分子》教学设计含教学反思docx等2份教案配套教学资源,其中教案共12页, 欢迎下载使用。
高中化学人教版 (2019)选择性必修2第二节 分子晶体与共价晶体优质第二课时教学设计: 这是一份高中化学人教版 (2019)选择性必修2第二节 分子晶体与共价晶体优质第二课时教学设计,文件包含核心素养人教版高中化学选修二《分子晶体与共价晶体》第二课时课件pptx、核心素养人教版高中化学选修二《分子晶体与共价晶体》第二课时教学设计含教学反思docx等2份教案配套教学资源,其中教案共9页, 欢迎下载使用。














