



单元质量评价(五)(第五单元) 同步练习2023-2024 鲁教版化学 八年级全一册
展开
单元质量评价(五)(第五单元)
(60分钟 60分)
可能用到的相对原子质量:H—1 C—12 N—14
O —16 Na—23 Mg—24 S—32 Cl—35.5 Ca—40
一、选择题(本题包括15个小题,1~10小题每小题1分,11~15小题每小题2分,共20分。每小题只有一个选项符合题意)
1.质量守恒定律是自然界基本的规律之一。下列实验装置能用来验证质量守恒定律的是 (B)
2.将铜绿[Cu2(OH)2CO3]隔绝空气加热后的生成物中,不可能存在的是 (A)
A.SO2 B.CuO C.CO2 D.H2O
3.(2023·淄博高青模拟)青铜器表面有一层铜绿,形成铜绿的化学方程式为2Cu+O2+X+H2O===Cu2(OH)2CO3,则X的化学式为 (B)
A.CO B.CO2
C.Cu(OH)2 D.N2
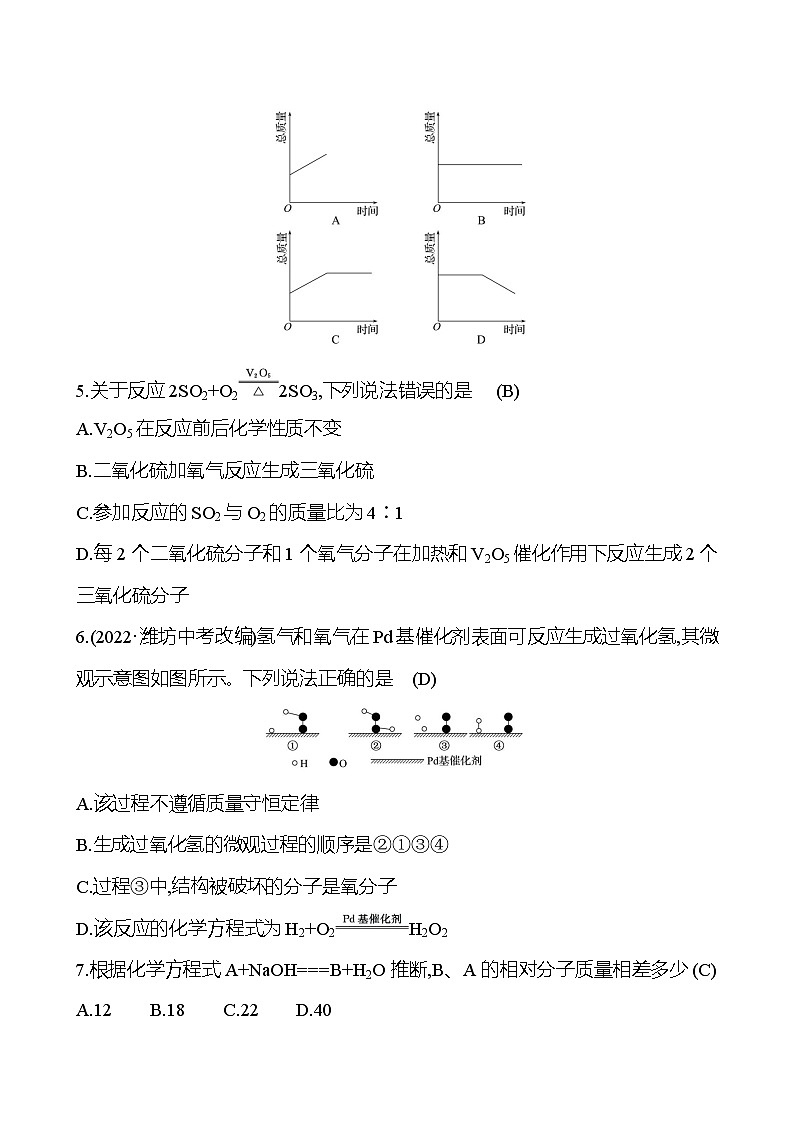
4.数形结合看变化有利于化学学习。下列图像能正确表示“在含有空气的密闭容器中加热镁带,容器中物质总质量的变化情况”的是 (B)
5.关于反应2SO2+O22SO3,下列说法错误的是 (B)
A.V2O5在反应前后化学性质不变
B.二氧化硫加氧气反应生成三氧化硫
C.参加反应的SO2与O2的质量比为4∶1
D.每2个二氧化硫分子和1个氧气分子在加热和V2O5催化作用下反应生成2个三氧化硫分子
6.(2022·潍坊中考改编)氢气和氧气在Pd基催化剂表面可反应生成过氧化氢,其微观示意图如图所示。下列说法正确的是 (D)
A.该过程不遵循质量守恒定律
B.生成过氧化氢的微观过程的顺序是②①③④
C.过程③中,结构被破坏的分子是氧分子
D.该反应的化学方程式为H2+O2H2O2
7.根据化学方程式A+NaOH===B+H2O推断,B、A的相对分子质量相差多少 (C)
A.12 B.18 C.22 D.40
8.下列化学方程式书写正确的是 (C)
A.H2O2H2O+O2↑
B.C+O2CO2↑
C.4P+5O22P2O5
D.4Fe+3O22Fe2O3
9.(2022·黄冈中考)2022年北京冬奥会秉持绿色、共享、开放、廉洁理念,首次采用氢气作为火炬燃料,计算完全燃烧0.4 kg氢气,理论上需要消耗氧气的质量是(A)
A.3.2 kg B.0.4 kg
C.0.8 kg D.2 kg
10.将16 g纯净物R在足量氧气中完全燃烧,生成44 g二氧化碳和36 g水。下列判断正确的是(A)
A.R只含碳、氢元素
B.消耗氧气32 g
C.R含碳、氢、氧三种元素
D.R中碳元素的质量分数为70%
11.图中,“”表示某种原子,“”表示另一种原子。下列反应能用该图表示的是 (D)
A.H2+Cl22HCl
B.N2+3H22NH3
C.2CO+O22CO2
D.2H2+O22H2O
12.下列对“质量守恒定律”的理解,正确的是 (C)
A.5 g冰融化成5 g水,说明符合质量守恒定律
B.蜡烛燃烧后,越来越短,最终消失,不符合质量守恒定律
C.任何化学反应中参加反应的各物质的质量总和都等于反应后生成的各物质的质量总和
D.镁条在空气中燃烧后,生成物的质量比原来的镁条大,不符合质量守恒定律
13.在反应X+2Y===2Q+R中,1.6 g X与足量的Y完全反应,生成4.4 g R,则a∶b等于(D)
物质 | X | Y | Q | R |
相对分子质量 |
|
| 18 | 44 |
参加反应或生成的物质的质量(g) | 1.6 | a | b | 4.4 |
A.23∶9 B.46∶9 C.32∶9 D.16∶9
14.(2022·威海中考)模型认知是化学研究的重要科学方法。如图是工业制取硝酸第一步反应的微观示意图。下列说法不正确的是 (A)
A.生成的丙、丁的分子个数比为1∶1
B.参加反应的甲、乙的质量比为17∶40
C.反应前后金属铂的质量和化学性质不变
D.丙是空气污染物之一
15.在一个密闭容器中,有甲、乙、丙、丁、戊五种物质,在一定条件下发生反应,测得反应前后各物质的质量变化量如图所示(图中正数表示物质质量的增加量,负数表示物质质量的减少量,0表示物质质量不变),下列说法正确的是 (C)
A.戊一定是该反应的催化剂
B.该反应前后分子的数目一定不变
C.参加反应的乙、丙的质量比一定为48∶23
D.该反应中甲、丁的相对分子质量之比一定为44∶27
二、理解与应用(本题包括4个小题,共18分)
16.(4分)下列化学方程式中分别有以下错误中的一种,请将相应字母填在题号后的横线上。
A.不符合反应客观事实
B.缺少反应条件
C.不符合质量守恒定律
D.缺少或用错“↑”或“↓”
E.反应条件错误
(1)Mg+O2MgO2 A 。
(2)C+O2CO2↑ D 。
(3)Al+O2Al2O3↑ C 。
(4)2KMnO4===K2MnO4+MnO2+O2↑ B 。
17.(4分)“宏观—微观—符号”之间建立联系是化学学科重要的思维方式。请根据如图示意图回答问题:
(1)写出该反应的化学方程式 2H2+O22H2O 。
该反应属于 化合反应 (填写基本反应类型)
(2)该反应前后氢元素的化合价变化情况为 升高 (填“升高”或“降低”)。
(3)该反应中没有发生改变的粒子是 氢原子、氧原子 (填粒子名称)。
18.(6分)(1)硫在氧气中燃烧的化学方程式是S+O2SO2。表示了参与反应的各物质之间的质量关系,即在点燃条件下,每 32 份质量的硫与 32 份质量的氧气恰好完全反应生成 64 份质量的二氧化硫。
(2)化学反应前后必定不发生改变的是 ①③⑤⑥ (填序号)。
①原子数目 ②分子数目 ③元素种类
④物质种类 ⑤原子种类 ⑥物质的总质量
(3)科学家采用新技术,将二氧化碳和氢气以一定比例混合,在一定条件下发生了如下反应:2CO2+6H2===4H2O+X,则X的化学式为 C2H4 。
(4)密闭容器中有甲、乙两种物质各10 g,加热一段时间后测得容器中各物质的质量如表所示:
物质 | 甲 | 乙 | 丙 | 丁 |
反应后质量/g | 1.5 | m | 0.8 | 2.2 |
下列选项正确的是 D 。
A.该反应为化合反应
B.m=5.5
C.丙、丁一定是单质
D.甲一定是化合物
19.(4分)质量守恒定律是自然界普遍规律,学习化学经常应用质量守恒定律分析问题。请回答:
(1)已知10 g A与一定质量的B恰好完全反应,生成9 g C和6 g D,则参加反应的B的质量为 5 g。
(2)为了减轻大气污染,在汽车尾气排放加装催化净化器,可将尾气中的NO、CO转化为两种无毒的且为空气成分的混合气体(转化过程中元素种类不变),这两种气体的化学符号是 N2 和 CO2 。
(3)将5 g某燃料在充足的氧气中完全燃烧,测得生成二氧化碳的质量为6.6 g,则该燃料中碳元素的质量分数为 36% 。
三、实验与探究(本题包括2个小题,共16分)
20.(10分)某化学兴趣小组的同学分别设计了验证质量守恒定律的实验如图:
(1)实验A中,发生化学反应的化学方程式为 4P+5O22P2O5 ,当红磷燃烧时观察到小气球的变化现象为 膨胀 (填“不变”“变瘪”或“膨胀”),当实验结束后发现小气球与初始状态相比 变瘪 (填“相同”“变瘪”或“膨胀”),小气球的作用除了密闭装置还有 平衡装置内外气压,防止瓶塞飞出 。
(2)实验B中,反应前天平平衡,然后将稀盐酸倒入烧杯中与石灰石小块充分反应后再称量,观察到反应后天平不平衡,则天平指针向 右 偏转,其原因是 反应生成的二氧化碳逸出装置 。
(3)如图C所示的小实验,在一根用细铜丝吊着的长玻璃棒两端分别绕上10 cm长的粗铜丝,并使玻璃棒保持水平;然后,用酒精灯给左边铜丝加热1~2分钟。冷却后,他们观察到的现象是
① a端红色固体变黑色 ,
② a端下降,b端上升 ,
其原因是 加热时铜和氧气反应生成氧化铜 。
(4)镁能和氧气反应,还能和氮气在点燃的条件下反应生成氮化镁(氮化镁中氮元素显-3价),请写出镁与氮气反应的化学方程式 3Mg+N2Mg3N2 。
21.(6分)化学兴趣小组为验证质量守恒定律,做镁条在空气中燃烧的实验(如图1)。同学们观察到镁条在空气中剧烈燃烧,发出耀眼的强光,产生的大量白烟弥漫到空气中,最后在陶土网上得到一些白色固体。
(1)镁条燃烧的化学方程式是 2Mg+O22MgO ;
(2)同学们通过称量发现:在陶土网上收集到产物的质量小于镁条的质量。小马认为这个反应不遵循质量守恒定律。你 不同意 (填“同意”或“不同意”)他的观点。你认为出现这种实验结果的原因可能是 反应生成的氧化镁部分扩散到空气中 ;
(3)小红按如图2装置改进实验,验证了质量守恒定律,还发现产物中有少量黄色固体。
【提出问题】黄色固体是什么?
【查阅资料】①氧化镁为白色固体;②镁能与氮气剧烈反应生成黄色的氮化镁(Mg3N2)固体;③氮化镁可与水剧烈反应产生氨气,该气体能使湿润的红色石蕊试纸变蓝。
【提出猜想】黄色固体是Mg3N2。
【实验探究】请设计实验,验证猜想
实验操作 | 实验现象 | 实验结论 |
将收集到的黄色固体放入试管中,加入适量的 水 ,在试管口放置湿润的红色石蕊试纸 | ① 产生气泡 ; ② 湿润的红色石蕊试纸变蓝色 | 黄色固体 是Mg3N2 |
四、分析与计算(本题包括1个小题,共6分)
22.(2023·淄博桓台期末)兴趣小组的同学要对我市南部山区某处石灰石的纯度(指石灰石中碳酸钙所占的质量分数)进行分析。取样品12 g研碎后倒入烧杯,然后注入100 g某浓度的稀盐酸(盐酸过量),搅拌。完全反应后称得烧杯内物质总质量是107.6 g。请分析并完成下列问题:(提示:CaCO3+2HCl===CaCl2+H2O+CO2↑)
(1)将样品研碎的目的是 增大与稀盐酸的接触面积,加快反应速度 。
(2)完全反应后烧杯内物质总质量跟原有物质总质量比较的变化情况是 减小 (填“增大”“减小”或“不变”)。
(3)计算该石灰石样品的纯度。
反应产生CO2的质量:12 g+100 g-107.6 g=4.4 g
设所含碳酸钙的质量是x。
CaCO3+2HCl===CaCl2+H2O+CO2↑
100 44
x 4.4 g
= x=10 g
该石灰石样品的纯度是×100%≈83.3%。
答:该石灰石样品的纯度是83.3%。









