




- 3.2 海水“晒盐” 课件---2023--2024学年九年级化学鲁教版(五四学制)全一册 课件 0 次下载
- 3.3 第1课时 氨碱法制纯碱 课件---2023--2024学年九年级化学鲁教版(五四学制)全一册 课件 0 次下载
- 4.1 常见的金属材料 课件---2023--2024学年九年级化学鲁教版(五四学制)全一册 课件 0 次下载
- 4.2 第1课时 金属与氧气的反应 金属与酸的反应 课件---2023--2024学年九年级化学鲁教版(五四学制)全一册 课件 0 次下载
- 4.2 第2课时 金属与盐溶液的反应 课件---2023--2024学年九年级化学鲁教版(五四学制)全一册 课件 0 次下载
初中化学鲁教版 (五四制)九年级全册3 海水“制碱”多媒体教学课件ppt
展开1.认识纯碱等盐类物质的重要性质2.知道复分解反应的概念、发生的条件和实质3.能判断复分解反应是否能发生,学会判断离子、物质能否共存。
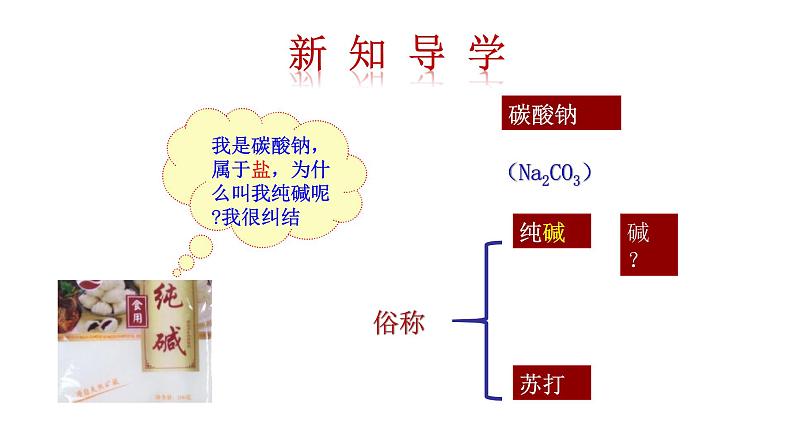
我是碳酸钠,属于盐,为什么叫我纯碱呢?我很纠结
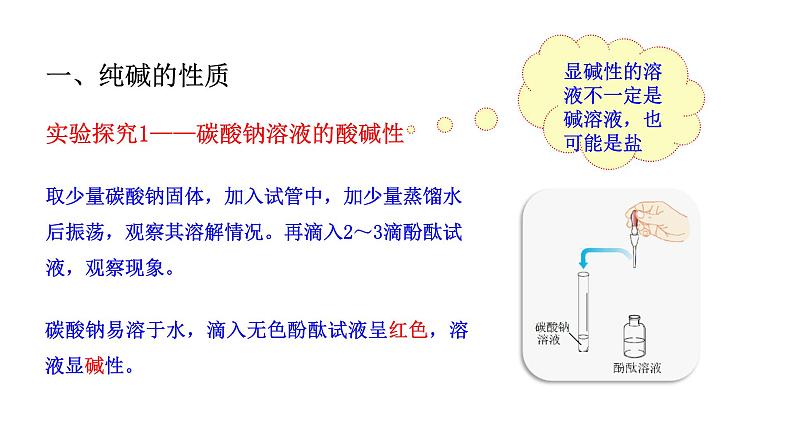
实验探究1——碳酸钠溶液的酸碱性
取少量碳酸钠固体,加入试管中,加少量蒸馏水后振荡,观察其溶解情况。再滴入2~3滴酚酞试液,观察现象。
碳酸钠易溶于水,滴入无色酚酞试液呈红色,溶液显碱性。
显碱性的溶液不一定是碱溶液,也可能是盐
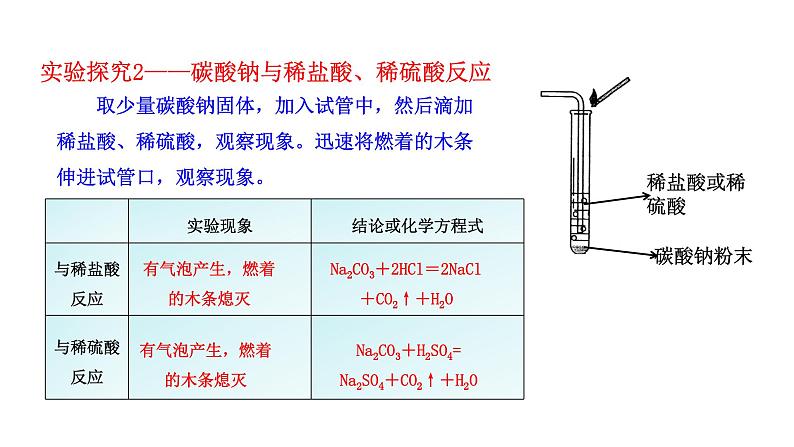
实验探究2——碳酸钠与稀盐酸、稀硫酸反应
取少量碳酸钠固体,加入试管中,然后滴加稀盐酸、稀硫酸,观察现象。迅速将燃着的木条伸进试管口,观察现象。
有气泡产生,燃着的木条熄灭
Na2CO3+2HCl=2NaCl+CO2↑+H2O
Na2CO3+H2SO4=Na2SO4+CO2↑+H2O
碳酸钠、碳酸氢钠与稀盐酸的反应
方法:取样品于试管中,加 入稀盐酸,有气泡产生,将 生成的气体通入澄清石灰水,石灰水变浑浊。说明样品中含有碳酸根离子或碳酸氢根离子。
药品:稀盐酸 澄清石灰水
Na2CO3+2HCl = 2NaCl+CO2↑+H2O
实验探究3——碳酸钠与与氢氧化钙反应
操作:向盛有少量碳酸钠溶液的试管中滴加澄清石灰水,观察现象。
Na2CO3 + Ca(OH)2 = CaCO3↓ +2NaOH
实验现象:有白色沉淀生成
实验探究4——碳酸钠与氯化钡反应
向盛有少量碳酸钠溶液的试管中滴加氯化钡溶液,观察现象。
Na2CO3+BaCl2=BaCO3↓+2NaCl
碳酸钠的化学性质:(1)水溶液呈碱性(2)能与大多数酸反应(3)能与氢氧化钙溶液反应(4)能与氯化钙溶液反应
Na2CO3+2HCl=2NaCl+CO2↑+H2ONa2CO3+H2SO4=Na2SO4+CO2↑+H2ONa2CO3+Ca(OH)2=CaCO3↓+2NaOHNa2CO3+BaCl2=BaCO3↓+2NaCl
特点:这四个反应是复分解反应,它们都是只交换成分,化合价不变
由两种化合物互相交换成分生成另外两种化合物的一类化学反应叫做复分解反应。
还记得什么是复分解反应吗?
酸、碱、盐之间发生的反应一般都属于复分解反应
酸碱盐之间是否一定能发生复分解反应呢?
实验探究5:复分解反应的条件
Na2CO3+CaCl2=2NaCl+CaCO3↓
在碳酸钠溶液和氢氧化钾溶液中分别存在着什么离子?它们的混合液中存在什么离子?为什么没有发生化学反应?
Na+、CO32-、K+和OH-
混合液中离子的种类和数量没有发生变化,即两种物质之间没有发生化学反应。
为什么碳酸钠溶液能与氯化钙溶液发生反应?
在两种溶液混合时, CO32-与Ca2+结合生成的CaCO3沉淀,Na+和Cl-仍留在溶液中,形成NaCl溶液。
碳酸钠与氢氧化钙溶液能发生反应生成NaOH和CaCO3
并不是任何酸、碱、盐和金属氧化物之间都能发生复分解反应,只有当两种化合物相互交换成分,且有沉淀、气体或水生成时,复分解反应才能发生。
盐的溶解性口诀:钾、钠、铵、硝酸盐全都溶,盐酸盐除银不溶,硫酸钡不溶,碳酸盐只溶钾、钠、铵。
说明:1.钾、钠、铵、硝酸盐都可溶。 2.盐酸盐只有氯化银不溶。 3.硫酸盐只有硫酸钡不溶。 4.碳酸盐只溶钾、钠、铵,剩下都不溶。
1.酸都溶2.可溶性碱有五位:钾、钠、铵、钙、钡。
从微观角度看Na2CO3与HCl的反应:
Na2CO3和稀HCl
BaCl2和稀H2SO4
4、复分解反应的应用:
溶液中离子、化合物是否可以共存
Mg2+ Fe3+ Cu2+ Al3+ NH4+
Ca2+ 、Ba2+等
以下离子在溶液中不能共存
1. 盐 + 金属→盐 + 金属如:Fe + CuSO4=Cu + FeSO4 Cu + 2AgNO3=2Ag + Cu(NO3)2
2. 盐 + 酸→盐 + 酸如:CaCO3 + 2HCl =CaCl2 + H2O + CO2↑( ) HCl + AgNO3 = AgCl↓ + HNO3( ) H2CO3 + CaCl2 = CaCO3↓ + 2HCl( ) Na2SO4 + 2HCl = 2NaCl + H2SO4( )
3. 盐 + 碱→盐 + 碱
如: CuSO4 + 2NaOH = Na2SO4 +Cu(OH)2↓( ) Na2CO3 +Ca(OH)2= 2NaOH + CaCO3↓( ) NaOH + KCl = NaCl + KOH( )
条件:①满足复分解条件,即有沉淀或气体或水生成;②反应物均必须可溶。
如:AgNO3+NaCl==AgCl↓+NaNO3( ) BaCl2 + Na2SO4=BaSO4↓+ 2NaCl( ) BaCO3 + Na2SO4=BaSO4↓+ Na2CO3( )
4. 盐 + 盐→盐 + 盐
条件:①满足复分解条件,②反应物均必须可溶。
常见盐的保健功能1.高锰酸钾(又称PP粉):具有强氧化性,能杀死病菌,常用以消毒。其中,它的深紫色溶液(约0.3%~0.5%)杀菌力最强,多用于浴缸、便具、痰盂的消毒;紫红色溶液(约0.05%)可用于清洗伤口,浸洗足癣,也可用于对瓜果、蔬菜及餐具的消毒;浅红色溶液(0.01%以下)可用于漱口,有除臭消炎防龋作用。
2.硫酸亚铁:亚铁离子是血红蛋白的重要成分,硫酸亚铁可用于治疗缺铁性贫血。许多补血糖浆中均含有硫酸亚铁。3.氯化钙:人体内的钙,是保证骨骼硬度、促进骨骼生长的主要成分。口服或注射氯化钙,可防治佝偻病、软骨病。与维生素D合用能更好地促进钙的吸收和储存。
4.碳酸钙:是自然界中大理石、石灰石、珍珠的主要成分,实验室常用它做制取二氧化碳的原料: CaCO3+2HCl ===== CaCl2+H2O+CO2↑ 碳酸钙除了可做补钙剂,还是牙膏内的摩擦剂,通常由纯碱和熟石灰反应制得,反应的化学方程式为Na2CO3+Ca(OH)2 ==== CaCO3↓+2NaOH。
5.亚硝酸钠(NaNO2) ——小心亚硝酸钠成为“杀手” 亚硝酸钠是工业用盐,它是一种白色不透明晶体,形状很像食盐,是致癌物质。其不仅存在于午餐肉中,在香肠、火腿等一些腌腊制品中都非常常见(主要作为一种增色剂、防腐剂使用,使肉颜色红润);尤其是煮过的剩菜中也存有亚硝酸钠。虽然亚硝酸钠是剧毒物质,但只要严格控制其食用量,对人体不会产生太大危害。
【典例1】(2021·湖州中考)某科学兴趣小组在课余时间做了“开门大吉”的游戏,其规则是:每把钥匙代表一种试剂,每扇门代表需要鉴别的两种溶液,见如图。如果钥匙代表的试剂能够鉴别出门上代表的两种溶液,钥匙就能把门打开(每把钥匙只能使用一次),下列能够依次将四扇门打开的钥匙顺序是( )A.①②③④ B.④②③① C.④③②① D.①③②④
知识点一、Na2CO3的性质
【典例2】根据复分解反应发生的条件,判断下列各组物质不能发生反应的一组是( )A.Na2CO3溶液和CaCl2溶液B.NaOH溶液和盐酸溶液C.CuSO4溶液和BaCl2溶液D.K2SO4溶液和NaCl溶液
1.判断下列化合物属于盐的是( )A.Na2O B.Mg(OH)2 C.H2SO4 D.NH4Cl E.Na2CO3 2.下列各组离子在pH=1的溶液中,能大量共存且溶液无色的是( )A.Cu2+、Na+、Cl﹣B.Na+、CO32﹣、NO3﹣C.NH4+、K+、SO42﹣D.Ag+、Mg2+、Cl﹣
3.下列稀溶液,仅用酚酞及同组物质之间反应就能鉴别出来的一组是( )A. NaOH H2SO4 HNO3 B. KOH HCl Ba(OH)2C. NaOH NaCl Na2CO3 D. NaOH NaCl HCl4.妈妈在洗碗筷时,经常在水中加入一种物质,很快就能将“油乎乎”的菜盘洗得干干净净。妈妈在水中加入的物质可能是( )A.汽油 B.烧碱 C.纯碱 D.食盐水
5、硫酸氢钠(NaHSO4)溶于水形成无色溶液,小明预测其化学性质并设计实验验证。下列有关说法不正确的是( )A.依据Ba2+与SO42﹣反应生成BaSO4沉淀,预测NaHSO4能与含Ba2+的盐反应B.向NaHSO4溶液中滴入BaCl2溶液,若有白色沉淀生成,则证明NaHSO4能与含Ba2+的盐反应C.向少量NaOH溶液中滴入NaHSO4溶液,通过观察溶液颜色的变化,验证NaHSO4与碱反应的预测是否正确D.向NaHSO4溶液中滴入Na2CO3溶液,有气泡产生,证明NaHSO4溶液呈酸性
Na2CO3 + 2HCl = 2NaCl +CO2↑+H2O
Na2CO3 + BaCl2 = BaCO3↓ +2NaCl
Na2CO3 + H2SO4 = Na2SO4 +CO2↑+H2O
化学九年级全册2 金属的化学性质课文配套ppt课件: 这是一份化学九年级全册2 金属的化学性质课文配套ppt课件,文件包含第2课时金属与盐溶液的反应ppt、微课湿法炼铜_标清wma等2份课件配套教学资源,其中PPT共15页, 欢迎下载使用。
初中化学鲁教版 (五四制)九年级全册3 海水“制碱”背景图ppt课件: 这是一份初中化学鲁教版 (五四制)九年级全册3 海水“制碱”背景图ppt课件,文件包含第1课时氨碱法制纯碱ppt、碳酸氢钠的作用有哪些mp4、碳酸钠的物理性质和用途mp4等3份课件配套教学资源,其中PPT共30页, 欢迎下载使用。
鲁教版 (五四制)1 溶液的形成教课课件ppt: 这是一份鲁教版 (五四制)1 溶液的形成教课课件ppt,文件包含第1课时溶解的过程乳化现象ppt、什么是溶液mp4、溶解时的吸热与放热mp4、肥皂为什么能去污mp4等4份课件配套教学资源,其中PPT共31页, 欢迎下载使用。













