



初中3 海水“制碱”图片课件ppt
展开信息分析 海水中含量最多的盐就是食盐(NaCI),我国海岸线漫长,可采用盐田法晒制而得。原料来源广,成本低,且和纯碱(Na2CO3)都属钠盐,在组成上都含钠元素。
大胆假设 ——食盐(NaCI)可以转化为纯碱(Na2CO3)
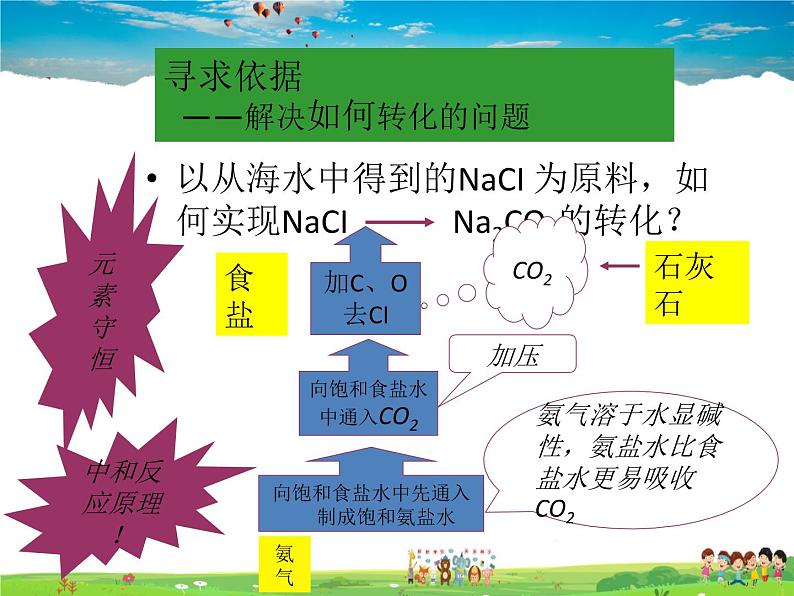
以从海水中得到的NaCI 为原料,如何实现NaCI Na2CO3的转化?
向饱和食盐水中通入CO2
向饱和食盐水中先通入 制成饱和氨盐水
氨气溶于水显碱性,氨盐水比食盐水更易吸收CO2
寻求依据 ——解决如何转化的问题
海水“制碱”的原料: 食盐、二氧化碳和氨气
使CO2更易食盐水吸收
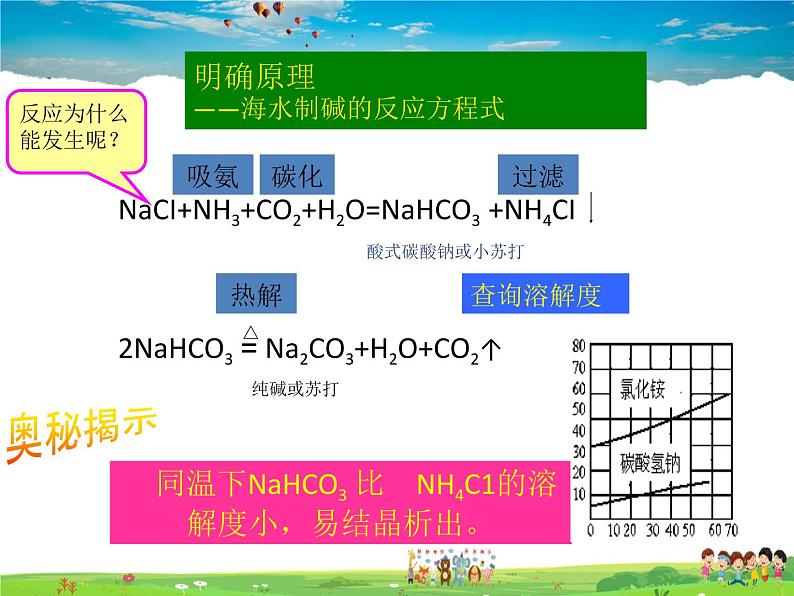
NaCI+NH3+CO2+H2O=NaHCO3 +NH4CI 2NaHCO3 = Na2CO3+H2O+CO2↑
同温下NaHCO3 比 NH4C1的溶解度小,易结晶析出。
明确原理——海水制碱的反应方程式
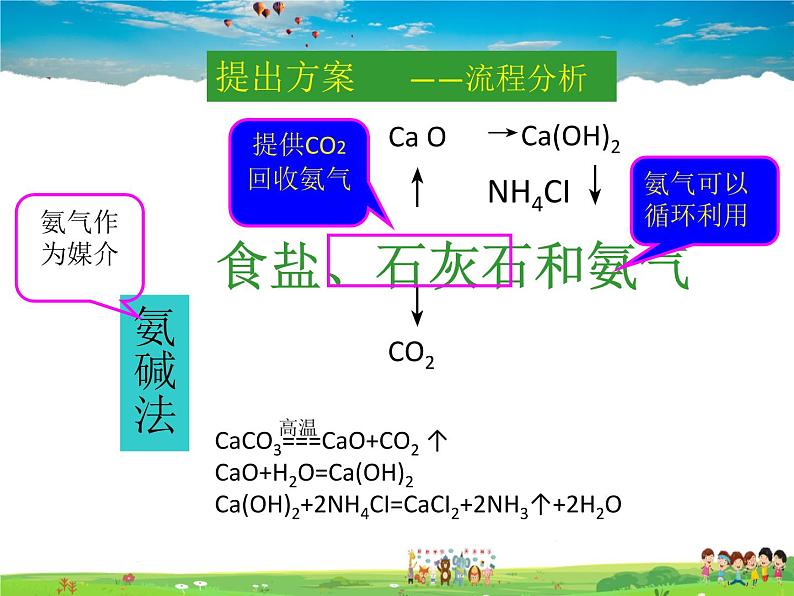
食盐、石灰石和氨气
CaCO3===CaO+CO2 ↑ CaO+H2O=Ca(OH)2Ca(OH)2+2NH4CI=CaCI2+2NH3↑+2H2O
→Ca(OH)2NH4CI↓
提出方案 ——流程分析
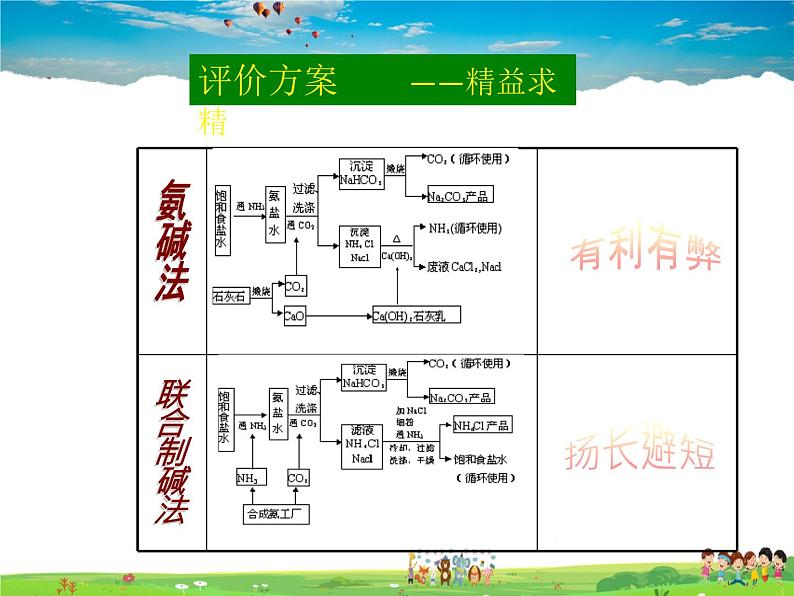
评价方案 ——精益求精
NaCl +NH3+CO2+H2O NaHCO3+ NH4Cl
2NaHCO3 Na2CO3+CO2↑+ H2O
思考:1.为什么采用饱和的食盐水?
3.氨盐水吸收二氧化碳后生成的碳酸 氢 钠和氯化铵,那种物质首先析出?为什么?
2.在生产过程中为什么要先通入氨气得到饱和的氨盐水后再通入二氧化碳?
凡是黄头发蓝眼睛的人能办到的,我们黑头发黑眼睛的人也一定能办到!
1862年比利时科学家索尔维发明了氨碱法制纯碱,并对制碱技术进行了垄断。
1921年10月侯德榜接受了永利碱业**学校的聘请,毅然从美国启程回国,决心自己开发制碱新工艺, 经过600多次研究实验,分析了2000多个样品,历时5年,于1942年发明并创立了举世闻名的“侯氏制碱法”。本可以高价出售这一专利而获得巨额财富的侯德榜却把它公布于众,让世界各国人民共享这一科技成果,促进了世界制碱技术的发展。
① NaCl+ NH3+ H2O + CO2=== NaHCO3↓+ NH4Cl② 2NaHCO3 Na2CO3 + H2O + CO2③向析出NaHCO3的母液中加入研细的NaCI,还得到另一 产品NH4CI固体。
不同:对过滤出NaHCO3后的母液的处理方法
产生了无用的氯化钙,用处不大,且污染环境
向析出NaHCO3的母液(氯化铵)中加入研细的NaCI,使NH4CI结晶析出,用作氮肥,氯化钠溶液可循环使用。
Na2CO3+2HCl=H2CO3+2NaCl
H2CO3=H2O+CO2↑
(1)能与酸反应,生成新酸和新盐
NaHCO3+HCl=H2CO3+NaCl
CaCO3+2HCl=H2CO3+CaCl2
例如:Na2CO3+Ca(OH)2=2NaOH+CaCO3↓
由两种化合物互相交换成分,生成另外两种化合物的反应,叫复分解反应。
写出NaOH与HCl反应的化学方程式。
NaOH+ HCl=NaCl+H2O
讨论:1.酸和碱反应生成盐和水,是复分解反应吗?为什么?
是复分解反应,因为两种反应物相互交换成分生成两种生成物。
2.分析、归纳上面几个反应中生成物的特点,思考复分解反应发生的条件。
两种反应物相互交换成分,生成物中有气体、沉淀或水生成时反应才能够进行。若是酸碱反应,至少有一种是可溶的;若是其它的反应,两种反应物都必须可溶。
结合课本判断下列反应能否发生
记住酸碱盐的溶解性是判断复分解反应基本要求,你有什么好方法快而准的记住它们吗?
酸都溶;溶碱有五位:钾、钠、铵、钙、钡;钾、钠、铵、硝酸盐都可溶;盐酸盐只有氯化银不可溶;硫酸盐只有硫酸钡不可溶;碳酸盐只溶钾、钠、铵、剩下都不溶。
梳理与反馈 一、知识梳理: 通过本节学习你有何收获? 二、反馈训练: 1.下列物质相互之间不能发生反应的是( ) A.NaOH、HCl B.BaCl2、Na2CO3 C.NaCl、Na2SO4 D.CuSO4、KOH 2.蒸馒头时,在发酵面团中加入某种物质,既能除去面团发酵产生的酸,又能使馒头松软,
1.生活中常见盐的用途;
2. CO32-、HCO3-的检验方法;
3.复分解反应发生的条件。
加入的这种物质是( ) A.氢氧化钠 B.碳酸钠 C.氯化钠 D.氧化钙 3.下列各组物质中,能在同一溶液中大量共存的是( ) A.Na2SO4、 Ba(OH)2 、HCl B.CuSO4、H2SO4、HNO3 C. Na2CO3、 NaOH、Ca(OH)2 D. K2SO4、 NaOH、Ba(NO3)2 4.欲除去氢氧化钠中的少量氢氧化钙,可以选用的试剂是( ) A.氢氧化钾溶液 B.碳酸钠溶液 C.氯化钡溶液 D.稀盐酸
酸跟碱完全反应的产物。
酸中的氢离子部分被中和的产物。
碱中的氢氧根离子部分被中和的产物。
此外,对于含有相同酸根离子或相同金属离子的盐,常给一个统称。如盐酸盐、钠盐等。
在金属活动性顺序表中,只有________的金属才能把________的金属从它的______中置换出来,与氢的位置___关。盐必须是______盐。
①金属 + 盐 → 新盐 + 新金属
不要用K、Ca、Na置换盐溶液中的金属。铁参加的置换反应生成的都是亚铁盐。
②盐 + 酸 → 新盐 + 新酸
③盐 + 碱 → 新盐 + 新碱
④盐 + 盐 → 新盐 + 新盐
①滴加稀盐酸,现象:有气泡产生;
②通入澄清石灰水,现象:生成白色浑浊。
①滴加硝酸钡,现象:生成白色沉淀;
②滴加稀硝酸,现象:沉淀不溶解。
①滴加氢氧化钠溶液,现象:有气泡产生;
②用红色石蕊试纸检验,现象:试纸变蓝。
①滴加硝酸银,现象:生成白色沉淀;
初中化学鲁教版九年级下册第三节 海水“制碱“背景图课件ppt: 这是一份初中化学鲁教版九年级下册第三节 海水“制碱“背景图课件ppt,共15页。PPT课件主要包含了讨论交流等内容,欢迎下载使用。
初中鲁教版第三节 海水“制碱“课文课件ppt: 这是一份初中鲁教版第三节 海水“制碱“课文课件ppt
鲁教版 (五四制)九年级全册3 海水“制碱”习题课件ppt: 这是一份鲁教版 (五四制)九年级全册3 海水“制碱”习题课件ppt,共20页。PPT课件主要包含了答案呈现,夯实基础·逐点练,NaHCO3,分解反应,整合方法·提升练,探究培优·拓展练等内容,欢迎下载使用。













