





高中化学人教版 (2019)选择性必修1第三节 盐类的水解优秀课时作业
展开高二化学同步学习高效学讲练(精准练习)
第三章 水溶液中的离子反应与平衡
第三节 盐类的水解
第1课时 盐类的水解
1.(2021·吉林·长春博硕学校高二期中)下列粒子能影响水的电离平衡,且能使水的电离平衡向右移动的是
A.CH3COOH B.OH- C.CO![]() D.Cl-
D.Cl-
2.(2021·重庆市天星桥中学高二阶段练习)下列有关pH=11的氨水和pH=11的碳酸钠溶液中水的电离程度的比较正确的是
A.前者大于后者 B.前者等于后者 C.前者小于后者 D.无法确定
3.(2022·广西钦州·高二期末)下列有关化学用语表示正确的是
A.![]() 电离:
电离:![]()
B.![]() 水解:
水解:![]()
C.泡沫灭火器制作原理:![]()
D.硫酸氢钠熔融状态下可发生电离:![]()
4.(2022·甘肃武威·高二期末)下列过程或现象与盐类的水解无关的是
A.加热氯化铁溶液的颜色变深
B.CaCO3的饱和溶液pH约为9.3
C.0.1mol/LAlCl3溶液中c(Al3+)<0.1mol/L
D.NaHCO3做发酵粉时加入柠檬酸后效果更好
5.(2022·广西桂林·高二期末)将稀氨水与等体积、等浓度的盐酸混合,所得溶液中相关离子浓度的关系错误的是
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
6.(2022·广西钦州·高二期末)已知25℃时,醋酸、碳酸、氢氰酸的电离平衡常数如表,下列分析错误的是
|
|
|
|
|
|
A.![]() 溶液中离子浓度的关系为:
溶液中离子浓度的关系为:![]()
B.等浓度的四种溶液,pH由大到小的顺序为:![]()
C.向NaCN溶液中通入少量![]() ,反应的离子方程式为:
,反应的离子方程式为:![]()
D.10mL![]() 的盐酸与醋酸溶液分别加水稀释至1000mL,稀释后溶液的pH,前者大于后者
的盐酸与醋酸溶液分别加水稀释至1000mL,稀释后溶液的pH,前者大于后者
7.(2021·河北省博野中学高二期中)25 ℃时,某氯化铵溶液的pH=4,下列叙述中不正确的是
A.溶液中的c(OH-)=1×10-10 mol·L-1
B.溶液中的c(Cl-)>![]() >c(H+)>c(OH-)
>c(H+)>c(OH-)
C.溶液中的c(H+)+![]() =c(Cl-)+c(OH-)
=c(Cl-)+c(OH-)
D.溶液中的c(NH3·H2O)=![]()
8.(2022·河北·石家庄二中高二期末)在pH=1的无色透明溶液中能大量共存的离子组是
A.Al3+、Cl-、Na+、S2- B.Fe2+、Na+、NO![]() 、SO
、SO![]()
C.Mg2+、NH![]() 、NO
、NO![]() 、Cl- D.Ba2+、K+、CO
、Cl- D.Ba2+、K+、CO![]() 、Cl-
、Cl-
9.(2021·江西·吉安县第三中学高二阶段练习)下列反应不属于水解反应或水解方程式不正确的是
①HCl+H2O ![]() H3O++Cl-
H3O++Cl-
②AlCl3+3H2O=Al(OH)3+3HCl
③CO![]() +2H2O
+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
④碳酸氢钠溶液:HCO![]() +H2O
+H2O![]() CO
CO![]() +H3O+
+H3O+
⑤HS-的水解:HS-+H2O![]() S2-+H3O+
S2-+H3O+
⑥NaAlO2与NaHCO3溶液混合:AlO![]() +HCO
+HCO![]() +H2O=Al(OH)3↓+CO
+H2O=Al(OH)3↓+CO![]()
A.①②③④ B.①②③⑥ C.②③⑤⑥ D.全部
10.(2021·浙江·嘉兴市第五高级中学高二期中)下列描述不正确的是
A.往Na2CO3溶液中加水,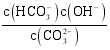 增大
增大
B.在滴有酚酞的Na2CO3溶液中慢慢滴入BaCl2溶液至过量,溶液的红色褪去
C.物质的量浓度相同的①NH4Cl、②CH3COONH4、③NH4HSO4三种溶液中c(![]() ):③>①>②
):③>①>②
D.在水电离出的c(H+)=1×10-12mol/L的溶液中,Al3+可能大量存在
11.(2022·江苏常州·高二期中)室温下,通过下列实验探究![]() 水解反应:
水解反应:![]() (黄色)
(黄色)![]()
![]() (红褐色)+3HCl的条件。
(红褐色)+3HCl的条件。
实验序号 | 实验操作 | 实验现象 |
1 | 将 | 溶液颜色变深 |
2 | 向 | 溶液颜色变浅 |
3 | 向 | _______ |
4 | 向 | 产生红褐色沉淀,同时产生气体 |
下列有关说法正确的是
A.实验1得到的溶液中有![]()
B.实验2中![]() 水解反应的化学平衡常数变小
水解反应的化学平衡常数变小
C.实验3得到的现象是溶液颜色变浅
D.实验4中反应的离子方程式为![]()
12.(2022·四川·射洪中学高二阶段练习)室温时,下列溶液中微粒的浓度关系正确的是
A.pH=8的NaClO溶液中:c(Na+)>c(ClO-)>c(OH-)>c(H+)
B.pH=4的KHC2O4溶液中:c(H2C2O4)>c(![]() )
)
C.相同物质的量浓度的NH4Cl溶液、NH4HSO4溶液、氨水溶液中,c(![]() )逐渐减小
)逐渐减小
D.在Na2S溶液中:c(Na+)=c(H2S)+c(HS-)+c(S2-)
13.(2022·广西·北海市教育教学研究室高二期末)下列溶液中有关微粒的物质的量浓度关系正确的是
A.![]() 溶液:
溶液:![]()
B.![]() 溶液:
溶液:![]()
C.物质的量浓度之比为![]() 的
的![]() 、
、![]() 混合液中:
混合液中:![]()
![]()
D.![]() 的
的![]() 溶液:
溶液:![]()
14.(2022·四川资阳·高二期末)下列物质形成的水溶液中,所含微粒种类最少的是
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
15.(2021·重庆市天星桥中学高二阶段练习)物质的量浓度相同的NaCN和NaClO相比,NaCN溶液的pH较大,则同温同体积同浓度的HCN和HClO相比较,下列说法中正确的是
A.电离程度:HCN>HClO
B.溶液的pH:HCN<HClO
C.酸根离子浓度:c(CN-)<c(ClO-)
D.与NaOH溶液恰好完全反应时,消耗NaOH的物质的量:HCN<HClO
16.(2021·河北省博野中学高二期中)已知NaHB在水溶液中存在关系式:c(Na+)=c(HB-)+c(B2-),下列说法中正确的是
A.H2B的电离方程式为:①H2B⇌H++HB-,②HB-⇌H++B2-
B.NaHB溶液中的离子浓度c(Na+)>c(HB-)>c(H+)>c(OH-)
C.NaHB水溶液呈碱性
D.c(Na+)+c(H+)=c(HB-)+c(B2-)+c(OH-)
17.(2022·福建泉州·高二期末)常温下![]()
![]() 溶液,下列说法正确的是
溶液,下列说法正确的是
A.加入少量![]() 固体,
固体,![]() 减小
减小
B.加入少量![]() 固体,减小
固体,减小![]() 减小
减小
C.稀释溶液,溶液的pH减小
D.加入适量醋酸得到的酸性混合溶液:![]()
18.(2022·福建龙岩·高二期末)常温下,将![]() 盐酸滴入
盐酸滴入![]() 氨水中,溶液
氨水中,溶液![]() 和温度随加入盐酸体积变化曲线如图所示。下列说法正确的是
和温度随加入盐酸体积变化曲线如图所示。下列说法正确的是
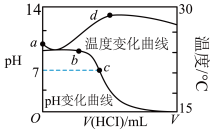
A.a点由水电离出的![]()
B.b点时![]()
C.c点时盐酸和氨水恰好完全反应
D.d点时消耗的盐酸体积:![]()
19.(2022·湖北武汉·高二期末)25℃时有以下5种溶液:①![]() 溶液:②
溶液:②![]() 溶液:③
溶液:③![]() 溶液:④
溶液:④![]() 溶液:⑤饱和
溶液:⑤饱和![]() 溶液。
溶液。
(1)溶液①的![]() _______7(填“>”、“<”或者“=”)。
_______7(填“>”、“<”或者“=”)。
(2)写出![]() 的电离方程式_______。
的电离方程式_______。
(3)①和②的溶液中水的电离程度为①_______②(填“>”、“<”或者“=”)。
(4)将②与③等体积混合后,溶液中存在的离子浓度由大到小的顺序是_______。
(5)用广泛![]() 试纸测得④的
试纸测得④的![]() ,请结合化学用语对
,请结合化学用语对![]() 溶液显酸性的原因进行完整说明_______。
溶液显酸性的原因进行完整说明_______。
(6)加热⑤可制备![]() 胶体,请结合化学用语解释_______。
胶体,请结合化学用语解释_______。
20.(2021·吉林·长春博硕学校高二期中)已知:
| H2CO3 | HF | HCN |
K或Ka1 | 4.3×10-7 | 7.2×10-4 | 4.9×10-10 |
Ka2 | 5.6×10-11 |
|
|
(1)在相同浓度的H2CO3和HF的溶液中,用“>”“<”或“=”填空。c(H+):H2CO3_______HF;c(F-)_______c(CO![]() )。
)。
(2)HCO![]() 、CO
、CO![]() 、F-、CN-结合质子能力:_______。
、F-、CN-结合质子能力:_______。
(3)H2CO3、HCO![]() 、HF、HCN酸性由强到弱的顺序为:_______。
、HF、HCN酸性由强到弱的顺序为:_______。
(4)将足量的二氧化碳通入到NaCN溶液中的离子方程式为_______。
21.(2022·宁夏·平罗中学高二期中)溶液中的化学反应大多是离子反应。请回答下列问题:
(1)pH=a的CH3COOH溶液稀释100倍后所得溶液pH_______a+2(填“>”或“<”)
(2)0.01mol·Lˉ1CH3COOH溶液的pH_______2(填“>”或“<”);
(3)0.1mol·Lˉ1CH3COONa溶液的pH_______7(填“>”或“<”);
(4)FeCl3溶液呈_______(填“酸”、“中”、“碱”)性,原因是(用离子方程式表示):_______;实验室在配制FeCl3溶液时,常将FeCl3固体先溶于较浓的盐酸中,_______(填“促进”、“抑制”)其水解,然后再用蒸馏水稀释到所需的浓度。
(5)若将pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后,混合溶液中c(Na+)_______c(CH3COO-)(填“>”“<”或“=”)。
(6)盐碱地(含较多Na2CO3、NaCl)不利于植物生长,试用化学方程式表示盐碱地产生碱性的原因:_______(用离子方程式表示);
22.(2022·湖南·长沙市长郡梅溪湖中学高二开学考试)10℃时,加热NaHCO3饱和溶液,测得该溶液的pH发生如表变化:
温度 | 10℃ | 20℃ | 30℃ | 加热煮沸后冷却到50℃ |
pH | 8.3 | 8.4 | 8.5 | 8.8 |
(1)甲同学认为:该溶液pH升高的原因是HCO-的水解程度增大,碱性增强。若将加热煮沸后的溶液冷却到10℃,若溶液的pH____(填“高于”“低于”或“等于”)8.3,则甲的判断正确。
(2)乙同学认为:该溶液pH升高的原因是NaHCO3受热分解,生成Na2CO3,并推断Na2CO3的水解程度_____(填“大于”或“小于”)NaHCO3的水解程度。
(3)丙同学认为:甲、乙的判断都不充分。丙认为:只要在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则乙的判断正确。试剂X是_____。A.Ba(OH)2溶液 B.BaCl2溶液 C.NaOH溶液 D.澄清石灰水
(4)查阅资料,发现NaHCO3的分解温度为150℃,丙断言____(填“甲”或“乙”)的判断是错误的,理由是_____。
(5)关于NaHCO3饱和水溶液的表述正确的是_____。
a.c(Na+)=c(HCO![]() )+c(CO
)+c(CO![]() )+c(H2CO3)
)+c(H2CO3)
b.c(Na+)+c(H+)=c(HCO![]() )+c(CO
)+c(CO![]() )+c(OH−)
)+c(OH−)
c.HCO![]() 的电离程度大于HCO
的电离程度大于HCO![]() 的水解程度
的水解程度
(6)已知25℃时,0.1mol·L-1HA溶液中![]() =108,碳酸的Ka1=4.3×10-7,Ka2=5.6×10-11,向等浓度的Na2CO3和NaA的溶液中滴加盐酸直至过量,则与H+作用的粒子依次为____。
=108,碳酸的Ka1=4.3×10-7,Ka2=5.6×10-11,向等浓度的Na2CO3和NaA的溶液中滴加盐酸直至过量,则与H+作用的粒子依次为____。
23.(2022·四川省绵阳南山中学高二阶段练习)已知25℃时电离常数:
酸 | H2CO3 | CH3COOH | HCN |
Ka | Ka1=4.5×10-7 Ka2=5.6×10-11 | 1.75×10-5 | 6.2×10-10 |
(1)H2CO3、CH3COOH、HCN三种酸中酸性最弱的是____。常温下,pH均为10的Na2CO3、CH3COONa、NaCN、NaHCO3四种溶液中,物质的量浓度最大的是____,该溶液中由水电离出c(H+)=____。
(2)泡沫灭火器的原理:____(用离子方程式表示)。
(3)常温下,向20mL0.01mol·L-1CH3COOH溶液中逐滴加入0.01mol·L-1KOH溶液,其pH变化曲线如图所示(忽略温度变化)。请回答下列有关问题
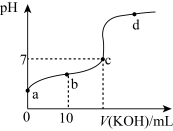
①若想观察滴定终点,滴定过程中宜选用____作指示剂(填“酚酞”、“石蕊”或“甲基橙”);
②b点时,混合溶液显____(填“酸性”、“中性”或“碱性”),此时溶液中离子浓度由大到小的顺序是____。
(4)常温下,向NaCN溶液中通入少量CO2发生反应的化学方程式为:____。
(5)在一定条件下,Na2CO3溶液中存在CO![]() +H2O
+H2O![]() HCO
HCO![]() +OH-平衡,下列说法正确的是____。
+OH-平衡,下列说法正确的是____。
A.稀释溶液,![]() 增大 B.通入CO2,溶液pH减小
增大 B.通入CO2,溶液pH减小
C.升高温度,水解平衡常数增大 D.加入Na2O固体,![]() 减小
减小
化学选择性必修1实验活动3 盐类水解的应用习题: 这是一份化学选择性必修1<a href="/hx/tb_c4002431_t7/?tag_id=28" target="_blank">实验活动3 盐类水解的应用习题</a>,共19页。试卷主要包含了盐类水解在生活中的应用非常广泛,下列实验操作能达到实验目的的是,下列有关化学实验的叙述正确的是,化学与生产、生活密切相关等内容,欢迎下载使用。
高中化学人教版 (2019)选择性必修1第三章 水溶液中的离子反应与平衡第三节 盐类的水解课后测评: 这是一份高中化学人教版 (2019)选择性必修1<a href="/hx/tb_c4002428_t7/?tag_id=28" target="_blank">第三章 水溶液中的离子反应与平衡第三节 盐类的水解课后测评</a>,共22页。试卷主要包含了下列有关化学用语表示正确的是,下列描述不正确的是等内容,欢迎下载使用。
人教版 (2019)选择性必修1第三章 水溶液中的离子反应与平衡第一节 电离平衡综合训练题: 这是一份人教版 (2019)选择性必修1<a href="/hx/tb_c4002426_t7/?tag_id=28" target="_blank">第三章 水溶液中的离子反应与平衡第一节 电离平衡综合训练题</a>,共19页。试卷主要包含了下列物质属于弱电解质的是,下列溶液导电能力最强的是,下列物质在水中最难电离的是等内容,欢迎下载使用。













