









- 《盐类的水解》第二课时课件PPT+教学设计 课件 22 次下载
- 《盐类的水解》第三课时课件PPT+教学设计 课件 24 次下载
- 《沉淀溶解平衡》第一课时课件PPT+教学设计 课件 24 次下载
- 《沉淀溶解平衡》第二课时课件PPT+教学设计 课件 24 次下载
- 《原电池》第一课时课件PPT+教学设计 课件 27 次下载
高中化学人教版 (2019)选择性必修1第三节 盐类的水解教学ppt课件
展开(人教版高中化学选择性必修1)
《盐类的水解》第四课时 教学设计
课题名 | 《盐类的水解》第四课时 |
教材分析 | 本节内容在学习了盐类水解的应用之后,主要要求学生掌握溶液中存在的三大守恒:电荷守恒、物料守恒、质子守恒,比较溶液中微粒浓度的大小关系。这些内容都是高考的常考点,也是学生容易丢分的题型。 |
教学目标 | 宏观辨识与微观探析:根据电解质的电离、弱离子的水解,判断溶液中微粒的种类。 证据推理与模型认知:书写溶液中存在的三大守恒:电荷守恒、物料守恒、质子守恒,比较溶液中微粒浓度的大小关系。 |
教学重点 | 溶液中存在的三大守恒、比较溶液中微粒浓度的大小关系。 |
教学难点 | 溶液中存在的三大守恒、比较溶液中微粒浓度的大小关系。 |
教学方法 | 讲解,举例 |
教学准备 | 教师准备:PPT 学生准备:预习课本 |
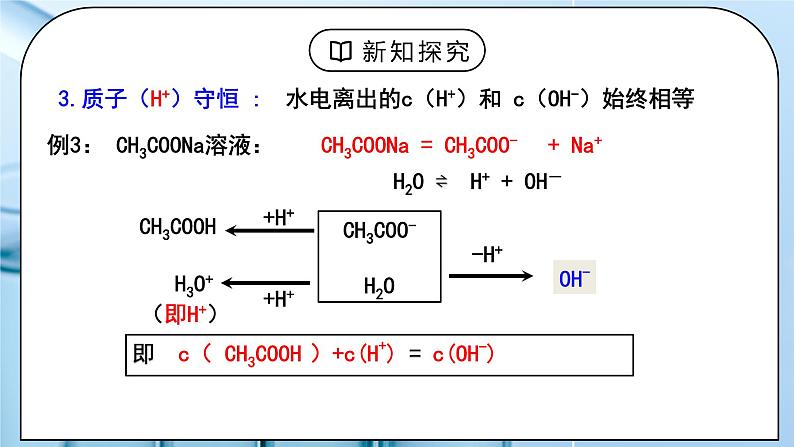
教学过程 | 一、新课导入 1.电解质的电离、弱离子的水解 教师:要求学生复习回顾电解质的电离、弱离子的水解。 学生:回顾电解质的电离、弱离子的水解的知识。 [设计意图]根据电解质的电离、弱离子的水解,能判断溶液中微粒的种类。为学习溶液中存在的三大守恒、溶液中微粒浓度的大小关系比较做准备。 二、探究新知 1.一、溶液中的守恒关系 教师:1.电荷守恒 : 本质:溶液呈电中性 规律:在溶液中所有阳离子所带的正电荷总数=所有阴离子所带的 负电荷总数 所有阳离子的电荷浓度之和 = 所有阴离子的电荷浓度之和 解题关键:①准确判断溶液中的离子的种类; ②注意每个粒子所带的电荷数,即Rn+的电荷浓度为nc(Rn+) 例1:Na2CO3溶液中: 阳离子:Na+ 、H+ 阴离子:OH– 、 CO32– 、 HCO3– ∵ 正电荷总数 = 负电荷总数 c(Na+)+c(H+)=c(HCO3-)+c(OH-)+ 2c(CO32-) 思考:碳元素存在于哪几种微粒中?这些微粒和钠离子物质的量之间有什么关系?
溶液中某一元素的原始浓度等于该元素在溶液中各种存在形式的 浓度之和 解题关键:①抓住电解质化学式中特定元素的原子间的定量关系; ②找出特定元素原子在溶液中的所有存在形式 例2:0.1 mol / L Na2CO3 溶液中: c (CO32–) + c (HCO3–) + c (H2CO3) = 0.1mol / L c (Na+ ) = 2 [c (CO32–) + c (HCO3–) + c (H2CO3) ] 3.质子(H+)守恒 : 水电离出的c(H+)和 c(OH-)始终相等 例3: CH3COONa溶液: c( CH3COOH )+c(H+) = c(OH-) 例4. Na2S溶液的质子守恒: c(HS- )+c(H+) +2c(H2S)=c(OH-) 质子守恒可由物料守恒和电荷守恒联合求得 学生:练习1:写出下列溶液中的电荷守恒式: (1)CH3COONa溶液 (2)NH4Cl溶液: (3)NaHCO3溶液 (4)Na2CO3和K2SO3的混合溶液 练习2:写出CH3COONa、NaHCO3溶液中的物料守恒式。 NaHCO3溶液的质量守恒: c (Na+)=c (HCO3–) + c (CO32–) + c (H2CO3) 练习3:写出NaHCO3溶液中的质子守恒式。 [设计意图]让学生学会书写电荷守恒、物料守恒、质子守恒 2.二、水溶液中的离子浓度大小的比较 教师:1.单一溶液 (1)弱酸或弱碱溶液 ① 弱电解质电离是微弱的 如: NH3 · H2O 溶液中: c (NH3 · H2O)> c (OH–)> c (NH4+)> c (H+) ② 多元弱酸电离是分步,主要决定第一步 如:H2S溶液中: c (H2S)> c (H+)> c (HS–)> c (S2–)> c (OH–) (2)可水解的盐(正盐)溶液 ① 水解是微弱的 如:NH4Cl 溶液中: c (Cl–)> c (NH4+)> c (H+)> c (NH3·H2O)> c (OH–) ② 多元弱酸水解是分步,主要决定第一步 如:Na2CO3 溶液中: c (Na+)> c (CO3–)> c (OH–)> c (HCO3–)> c (H+) (3)强碱弱酸的酸式盐溶液 显酸性:NaHSO3、NaH2PO4溶液 (以电离为主) 显碱性:NaHCO3、Na2HPO4、NaHS溶液(以水解为主) 理论依据:电离、水解都是微弱的 电离、水解都以第一步为主 考虑水的额外电离 (4)不同溶液中同一离子浓度大小的比较 例5:等物质的量的下列溶液中,NH4+的浓度由大到小的顺序是 ①NH4Cl ②NH4HCO3 ③ NH4HSO4 ④ NH4NO3 ⑤(NH4)2SO4 ⑥(NH4)2Fe(SO4) ⑦(NH4)2CO3 解题关键:其他离子对平衡移动的影响 ⑥>⑤>⑦>③>①=④>② 2.两种溶液混合 (1)只混合不反应——等浓度的弱酸或弱碱与其盐溶液等体积混合 思考:浓度均为0.1mol/L的CH3COOH与CH3COONa混合溶液中存在哪些微粒?这些微粒的浓度从大到小该如何排序? 解题关键:分析水解程度与电离程度的相对大小,才能判断不水解离子与水解离子浓度的相对大小 c(CH3COO-)>c(Na+)>c(H+)>c(OH-)。 (2)只混合不反应——等浓度的两种盐溶液等体积混合 例6:等浓度的Na2CO3溶液和NaHCO3溶液等体积混合后,溶液中的: 离子浓度大小关系: 电荷守恒: 物料守恒: 质子守恒: (2)混合后反应—— 两溶液恰好反应完 例7:在10 mL 0.1mol·L-1NaOH溶液中加入同体积、同浓度CH3COOH溶液,反应后溶液中各微粒的浓度大小顺序? 相当于盐溶液 c (Na+)>c (Ac-)>c (OH-)>c (H+) (2)混合后反应—— 两溶液未反应完 例8:把0.02 mol·L-1 CH3COOH溶液与0.01 mol·L-1NaOH溶液等体积混合,则混合液中微粒浓度关系正确的是( ) A、c(CH3COO -)>c(Na+) B、c(CH3COOH)>c(CH3COO -) C、2c(H+)=c(CH3COO -)-c(CH3COOH) D、c(CH3COOH) + c(CH3COO -)=0.01 mol·L-1 学生:练习4:写出下列浓度均为0.1mol/L的混合溶液中离子浓度的大小顺序 NH3·H2O与NH4Cl溶液 (已知Kb =1.75 ×10-5 ) HClO与NaClO溶液 (PH=8) HCN与NaCN溶液 (已知Ka =6.2 ×10-10 ) 练习5:将0.4 mol/LNH4Cl溶液和0.2 mol/LNaOH溶液等体积混合后,溶液中下列微粒的物质的量关系正确的是( ) A 、c(NH4+)=c(Na+)=c(OH-)>c(NH3·H2O) B、 c(NH4+)=c(Na+)>c(NH3·H2O) >c(OH-)>c(H+) C、 c(NH4+)>c(Na+)>c(OH-)>c(NH3·H2O) D、 c(NH4+)>c(Na+)>c(NH3·H2O) >c(OH-)>c(H+) 练习6:用均为0.1 mol的CH3COOH和CH3COONa配制成1L混合溶液,已知其中 c (CH3COO–) > c (Na+),对该混合溶液的下列判断正确的是( ) A. c (OH–) > c (H+) B. c (CH3COOH) + c (CH3COO– ) = 0.2 mol/L C. c (CH3COOH) > c (CH3COO– ) D. c (CH3COO– ) + c (OH– ) = 0.2 mol/L 练习7:硫化氢的水溶液中存在动态平衡:H2SH++HS-;HS- H++S2-;H2O H++OH-。在物质的量浓度为0.1 mol·L-1的H2S溶液中,下列各离子浓度的关系正确的是( ) A.c(H+)=c(HS-)+2c(S2-)+c(OH-) B.2c(H+)=2c(HS-)+c(S2-)+2c(OH-) C.c(H+)=c(HS-)+2c(S2-) D.c(H+)=2c(S2-)+c(OH-) [设计意图]让学生会比较溶液中离子浓度大小。 |
板书设计 | 一、溶液中的守恒关系 1.电荷守恒:分别找出阴、阳离子,算出所带电荷总数,注意所带电荷数 2.物料守恒:找出原子比例关系,列出存在形式 3.质子守恒:找出原子比例关系,列出存在形式 二、水溶液中的离子浓度大小的比较 1.单一溶液 2.两种溶液混合 |
课后作业 |
练习册上相关习题 |
教学反思 | 亮点:本节课举出典型例子讲解了溶液中存在的三大守恒:电荷守恒、物料守恒、质子守恒,也详细列举了判断溶液中离子浓度的大小的几种类型。 课堂教学建议:本节课内容多难度大,教师应根据学生的具体情况选择例题和练习题让学生学习。 |
高中化学人教版 (2019)选择性必修1第三节 盐类的水解教学课件ppt: 这是一份高中化学人教版 (2019)选择性必修1第三节 盐类的水解教学课件ppt,文件包含《盐类的水解》第三课时课件pptx、《盐类的水解》第三课时教学设计docx等2份课件配套教学资源,其中PPT共22页, 欢迎下载使用。
高中化学人教版 (2019)选择性必修1第三章 水溶液中的离子反应与平衡第三节 盐类的水解教学课件ppt: 这是一份高中化学人教版 (2019)选择性必修1第三章 水溶液中的离子反应与平衡第三节 盐类的水解教学课件ppt,文件包含《盐类的水解》第二课时课件pptx、《盐类的水解》第二课时教学设计docx等2份课件配套教学资源,其中PPT共20页, 欢迎下载使用。
高中化学第三节 盐类的水解教学ppt课件: 这是一份高中化学第三节 盐类的水解教学ppt课件,文件包含《盐类的水解》第一课时课件pptx、《盐类的水解》第一课时教学设计docx等2份课件配套教学资源,其中PPT共24页, 欢迎下载使用。














