






人教版 (2019)必修 第二册第二节 氮及其化合物备课ppt课件
展开第五章 化工生产中的重要非金属元素
第2节 氮及其化合物
5.2.6 硝酸的相关计算
巩固硝酸的强氧化性.掌握金属与硝酸反应的常用方法.
深度学习 多角度突破HNO3的氧化性
1.对硝酸强氧化性的正确认识本质 HNO3中的+5价氮元素具有很强的得电子能力(1)浓硝酸能使紫色石蕊溶液先变红,后褪色。(2)反应温度越高,硝酸浓度越大,其氧化性越强。(3)硝酸与铁反应,当硝酸过量时,产物为Fe(NO3)3,当铁过量时为Fe(NO3)2。(4) 在中性和碱性溶液中不表现强氧化性,但在酸性溶液中表现强氧化性,与I-、Fe2+、 、S2-等不能共存。Br-与 在中性、碱性条件下能共存,而在酸性条件下因发生氧化还原反应而不能大量共存。
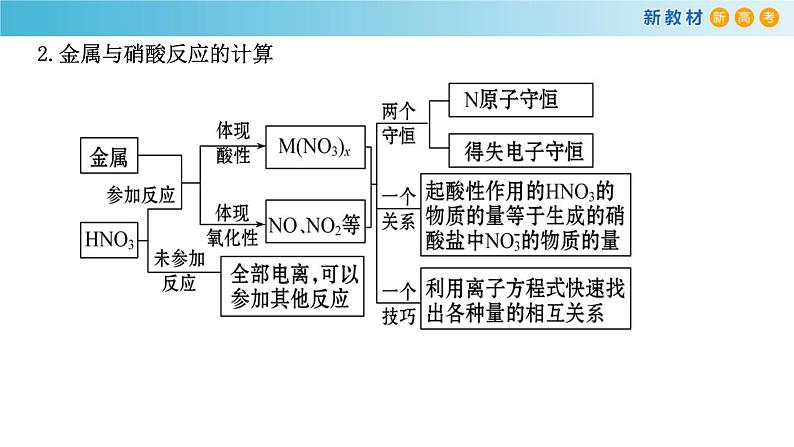
2.金属与硝酸反应的计算
Cu + 4HNO3(浓) = Cu(NO3)2 + 2NO2 ↑ + 2H2O
HNO3与金属反应时,一部分HNO3起酸的作用以NO3-的形式存在于溶液中;一部分作为氧化剂转化为还原产物,这两部分中氮原子的总物质的量等于反应消耗的HNO3物质的量。
n(反应的硝酸)= n(被还原的硝酸)+ n(未被还原的硝酸) = n(被反应的硝酸)+2n(Cu2+)
例1、38.4克的Cu与适量的浓HNO3反应,铜全部溶解,共收集到22.4L气体,则反应消耗HNO3的物质的量为 ________
n(反应的硝酸)= n(被还原的硝酸)+ n(未被还原的硝酸) = n(被反应的硝酸)+2n(Cu2+) = 22.4L/22.4L/ml+2ⅹ38.4g/64g/ml =2.2ml
例跟含有1.4×10-3 ml的硝酸恰好完全反应,反应完毕后收集到的气体在标准状况下的体积为( ) A.7.84 mL B.13.44 mL C.15.68 mL D.17.92 mL
解析:扩放数据,简化计算n(Cu)=0.4ml,生成0.4mlCu(NO3)2,故生成气体为1.4ml-0.4ml×2=0.6ml,气体体积为0.6×22.4=13.44L。
HNO3与金属的反应属于氧化还原反应,HNO3中氮原子得电子的物质的量等于金属电子的物质的量。
例3.某二价金属与硝酸反应时,金属与硝酸所消耗的物质的量之比为2:5,则HNO3的还原产物是 ( ) A.NH4NO3 B.N2O C.NO D.NO2
解析:若二价金属(M)为2ml,生成2mlM(NO3)2,未被还原的硝酸4ml,被还原的硝酸1ml,根据得失电子数相等,HNO3中N元素被还原成+1价,应为N2O;NH4NO3中N元素的平均化合价为+1价。答案AB。
例4:mgCu投入一定量浓硝酸中,铜完全溶解,生成气体颜色越来越浅,共收集到VmL气体。将盛有此气体的容器倒扣在水中,通入标准状况下一定体积的O2,恰好使气体完全溶于水中,则通入O2的体积的计算. 方法:若从一般角度考虑,很难得出结论;但若利用得失电子守恒解,能得到铜失去的电子总数等于氧气 得到的电子总数,即有2n(Cu)=4n(O2 )
A.1∶4 B.1∶5 C.2∶3 D.2∶5
练1.物质的量之比为2∶5的锌与稀硝酸反应,若硝酸被还原的产物为N2O,反应结束后锌没有剩余,则该反应中被还原的硝酸与未被还原的硝酸的物质的量之比是( )
练2、1.92 g Cu投入到一定量的浓硝酸中,铜完全溶解,生成的气体的颜色越来越浅,共收集到 672 mL 的气体(标准状况下),将盛有此气体的容器倒扣在水槽中,通入标准状况下一定体积的氧气,恰好使气体完全溶于水,则通入的氧气的体积为( )mLA.168 B.224 C. 336 D.504
练3 、铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,这些气体与5.6LO2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。则消耗铜的质量为( )A.16g B.32g C.64g D.无法计算
HNO3过量时反应后溶液中(不考虑OH-)则有: c(NO3- )=c(H+)+nc(Mn+)(Mn+代表金属离子)。
例5. 3.2 g铜与过量硝酸反应,硝酸被还原为NO2和NO。反应后溶液中含H+ a ml,则此时溶液中含NO3-的物质的量为__________ml。
解析: 反应后的溶液中溶质是:Cu(NO3)2和HNO3。n(NO3-)=2n(Cu)+n(H+)=2×0.05+a=(0.1+a)ml
④利用离子方程式计算法
金属与H2SO4、HNO3的混合酸反应时,由于硝酸盐中NO 3- 在H2SO4提供H+的条件下能继续与金属反应,因此此类题目应用离子方程式来计算,先作过量判断,然后根据完全反应的金属或H+或NO3-进行相关计算,且溶液中要符合电荷守恒。
例6. 1L稀硝酸和稀硫酸的混合液,其物质的量浓度分别为0.1ml/L和0.4ml/L。若向该混合液中加入足量的铜粉,则最多能溶解铜粉的质量为 ( ) C. 6.4g
解析:n(H+)=0.1+0.8=0.9(ml) n(NO3-)=0.1ml 3Cu + 8H+ + 2NO3-=3Cu2++2NO↑+4H2O 3ml 8ml 2ml 0.9ml 0.1ml NO3-不足,溶解n(Cu)=0.15ml;m(Cu)=9.6(g)
ml·L-1 B.0.2 ml·L-1 ml·L-1 ml·L-1
练4.将2.56 g铜粉加入100 mL 0.4 ml·L-1的稀HNO3溶液中,加热充分反应后再加入100 mL 0.2 ml·L-1的H2SO4溶液,继续加热,待充分反应后,所得溶液中Cu2+的物质的量浓度是(忽略溶液体积变化)( )
⑤金属与酸再与碱反应: 转移的电子的物质的量等于消耗的OH-物质的量
例7、将11.9 g由Mg、Al、Fe组成的合金溶于足量的NaOH溶液中,合金质量减少了2.7 g。另取等质量的合金溶于过量稀硝酸中,生成了6.72 L NO(标准状况下),向反应后的溶液中加入适量NaOH溶液恰好使Mg2+、Al3+、Fe3+完全转化为沉淀,则沉淀的质量为( )A.22.1 g B.27.2 g C.30 g D.无法计算
练5:将0.51ml铜与140mL一定浓度的硝酸溶液反应,铜完全溶解, 产生NO和NO2混合气体0.5ml。
(1)NO的物质的量为 ;NO2的物质的量为 。
(2)要使反应生成的气体全部转化为HNO3,需要O2 ml
(3)欲使铜与硝酸反应生成的气体在NaOH溶液中全部转 化为NaNO3,至少需要30%的双氧水 g。
(4)待产生的气体全部逸出后,向溶液中加入V mL a ml·L-1的 NaOH溶液,恰好使溶液中的Cu2+完全转化为沉淀,则原硝 酸溶液的浓度为 ml·L-1
高中化学人教版 (2019)必修 第二册第二节 氮及其化合物备课ppt课件: 这是一份高中化学人教版 (2019)必修 第二册第二节 氮及其化合物备课ppt课件,共36页。PPT课件主要包含了视频清单,素养目标,证据推理与模型认知,科学探究和社会责任,强水是什么,无色液体,有刺激性气味,物理性质,瓶口有白雾,不稳定性等内容,欢迎下载使用。
化学必修 第二册第二节 氮及其化合物课文课件ppt: 这是一份化学必修 第二册第二节 氮及其化合物课文课件ppt,共19页。PPT课件主要包含了氮及其化合物的转化,学习目标,金属与硝酸反应的计算,a+01等内容,欢迎下载使用。
高中化学人教版 (2019)必修 第二册第七章 有机化合物第三节 乙醇与乙酸备课ppt课件: 这是一份高中化学人教版 (2019)必修 第二册第七章 有机化合物第三节 乙醇与乙酸备课ppt课件,共22页。PPT课件主要包含了醋的来历,乙酸的物理性质,CH3COOH或,乙酸的分子结构,乙酸酯化反应机理,结构决定性质等内容,欢迎下载使用。













