






- 《化学反应速率》第一课时课件PPT+教学设计 课件 33 次下载
- 《化学反应速率》第二课时课件PPT+教学设计 课件 31 次下载
- 《化学平衡》第一课时课件PPT+教学设计 课件 30 次下载
- 《化学平衡》第二课时课件PPT+教学设计 课件 24 次下载
- 《化学平衡》第三课时课件PPT+教学设计 课件 24 次下载
人教版 (2019)选择性必修1第一节 化学反应速率优质课教学ppt课件
展开1.了解基元反应、碰撞理论,了解活化能、活化分子等概念。能用相关理论解释外界条件对反应速率的影响机理。2.了解通过改变外界条件改变反应速率的方法和意义。重点:用活化能、碰撞理论相关理论解释外界条件对反应速率的影响机理难点:用活化能、碰撞理论相关理论解释外界条件对反应速率的影响机理
影响化学反应速率的因素
内因:反应物或反应本身的性质
温度:升高温度,化学反应速率增大;反之减小实验测得,温度每升高10度,化学反应速率通常增大原来的2~4倍。
催化剂:使用催化剂,化学反应速率增大 能同等程度改变化学反应的速率。
浓度:增大浓度,化学反应速率增大;反之减小
其他:增大固体反应物的表面积,化学反应速率增大;反之减小
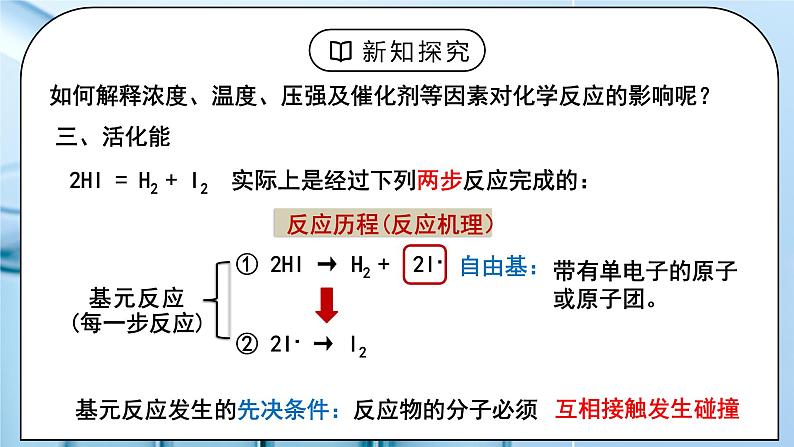
如何解释浓度、温度、压强及催化剂等因素对化学反应的影响呢?
2HI = H2 + I2 实际上是经过下列两步反应完成的:
① 2HI → H2 + 2I·
带有单电子的原子或原子团。
反应历程(反应机理)
基元反应发生的先决条件:反应物的分子必须____________________
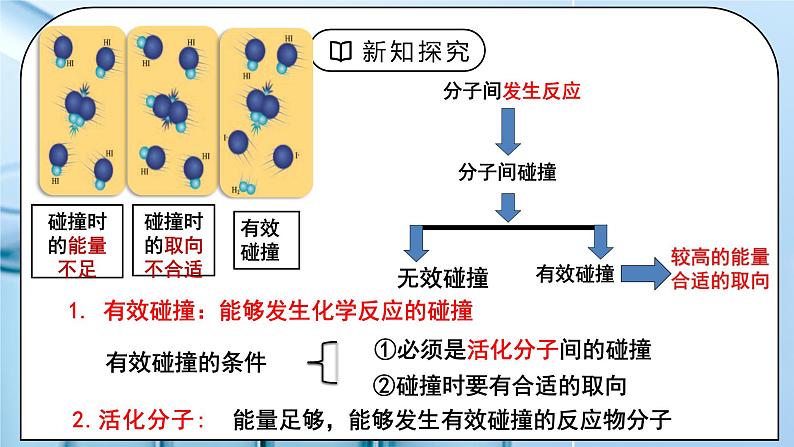
1. 有效碰撞:能够发生化学反应的碰撞
①必须是活化分子间的碰撞
②碰撞时要有合适的取向
能量足够,能够发生有效碰撞的反应物分子
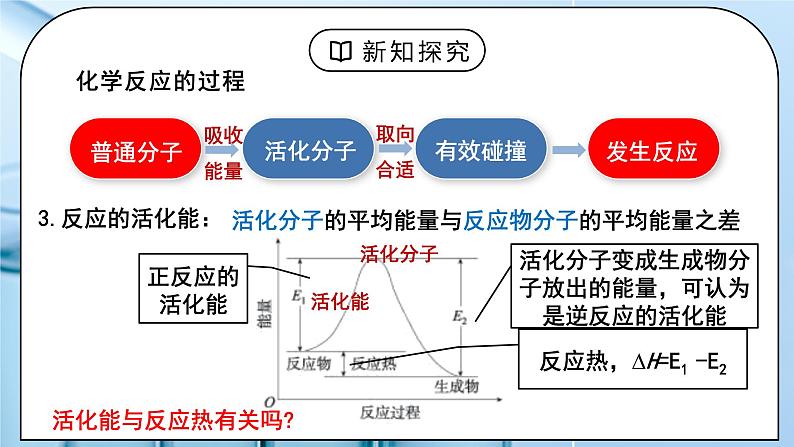
活化分子的平均能量与反应物分子的平均能量之差
活化分子变成生成物分子放出的能量,可认为是逆反应的活化能
反应热,∆H=E1 -E2
活化能与反应热有关吗?
有效碰撞理论影响化学反应速率因素的解释:
活化能与反应速率的关系:一定条件下,活化分子百分数是固定不变的。活化分子百分数:(活化分子数/反应物分子总数)×100%即:活化能越低,活化分子百分数越大,单位体积活化分子数越多,有效碰撞次数多,化学反应速率快
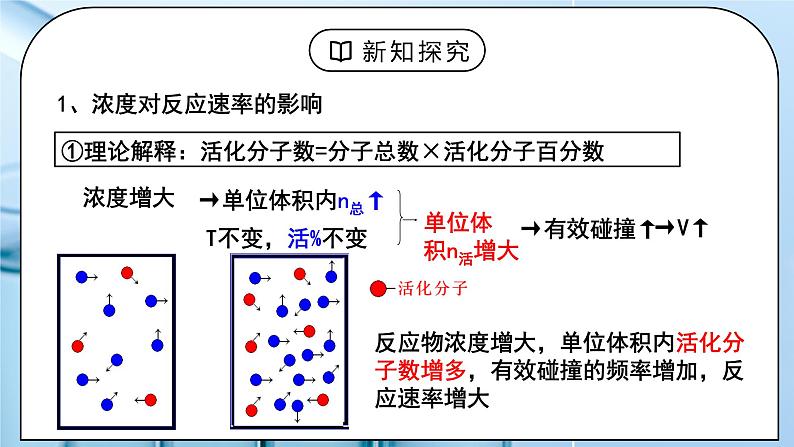
1、浓度对反应速率的影响
①理论解释:活化分子数=分子总数×活化分子百分数
反应物浓度增大,单位体积内活化分子数增多,有效碰撞的频率增加,反应速率增大
2、压强对反应速率的影响
原因:对气体来说,若其他条件不变,增大压强,就是增加单位体积的反应物的物质的量,即增加反应物的浓度,因而可以增大化学反应的速率。
理论解释:①请试根据浓度对化学反应速率的影响推出压强对化学反应速率的影响情况
→ 体积减小 其他条件不变
改变压强的涵义:引起浓度变化
ⅰ、恒温时,改变容器容积:增大压强→体积减少→C增大→反应速率增大
ⅱ、恒温、恒容时: 充入气体反应物→反应物浓度增大→总压增大→反应速率增大; 充入“无关气体”(如He、N2等)→引起总压增大,各物质的浓度不变→反应速率不变
ⅲ、恒温,恒压时:充入“无关气体”(如He等)→引起体积增大, →各反应物浓度减少→反应速率减慢。
3、温度对反应速率的影响
理论解释:其他条件不变时,升高温度,一部分非活化分子吸收能量转化为活化分子,使得活化分子百分数提高,活化分子间的有效碰撞频率变大,故反应速率增大。
4、催化剂对反应速率的影响
理论解释:使用催化剂,能够降低反应所需的能量,这样会使更多的反应物的分子成为活化分子,大大增加单位体积内反应物分子中活化分子所占的百分数。因而使反应速率加快。
活化分子变成生成物分子放出的能量
活化分子、有效碰撞与反应速率的关系
外界条件对化学反应速率的影响
练习1、有关碰撞理论,下列说法不正确的是 ( )A.具有足够能量的分子(活化分子)相互碰撞就一定能发生化学反应B.增大反应物的浓度,单位体积内活化分子数增多,有效碰撞的几率增大,反应速率增大C.升高温度,活化分子百分数增大,有效碰撞的几率增大,反应速率增大D.催化剂能降低反应的活化能,提高活化分子百分数,有效碰撞的几率增大,反应速率增大
练习2、对于反应N2(g)+O2(g)===2NO(g),在密闭容器中进行,下列哪些条件一定能加快该反应的速率( )A.增大体积B.体积不变充入N2使压强增大C.体积不变充入He使压强增大D.压强不变充入N2使体积增大
练习3、在一密闭容器中充入2 ml H2和2 ml I2,压强为p,在一定温度下发生H2(g)+I2(g) 2HI(g)的反应:(1)恒容条件下,向其中加入1 ml H2,反应速________(填“增大”“减小”或“不变”,下同)。 (2)恒容条件下,向其中加入1 ml Ar,反应速率________。 (3)恒压条件下,向其中加入1 ml Ar,反应速率________。
练习4、硫代硫酸钠溶液与稀硫酸反应的化学方程式为Na2S2O3+H2SO4===Na2SO4+SO2↑+S↓+H2O,下列各组实验中最先出现浑浊的是( )
练习5、在一定条件下,容积为2 L的密闭容器中,将2 ml L气体和3 ml M气体混合,发生如下反应:2L(g)+3M(g)===xQ(g)+3R(g),10 s末,生成2.4 ml R,并测得Q的浓度为0.4 ml·L-1。计算:(1)10 s末L的物质的量浓度为______________。(2)前10 s内用M表示的化学反应速率为________。(3)化学方程式中x值为________。(4)在恒温恒容条件下,往容器中加入1 ml氦气,反应速率________(填“增大”“减小”或“不变”,下同)。(5)在恒温恒压条件下,往容器中加入1 ml氦气,反应速率________。
0.12 ml·L-1
高中化学人教版 (2019)选择性必修1第三节 盐类的水解教学课件ppt: 这是一份高中化学人教版 (2019)选择性必修1第三节 盐类的水解教学课件ppt,文件包含《盐类的水解》第三课时课件pptx、《盐类的水解》第三课时教学设计docx等2份课件配套教学资源,其中PPT共22页, 欢迎下载使用。
高中人教版 (2019)第二节 化学平衡精品教学课件ppt: 这是一份高中人教版 (2019)第二节 化学平衡精品教学课件ppt,文件包含《化学平衡》第三课时课件pptx、《化学平衡》第三课时教学设计docx等2份课件配套教学资源,其中PPT共30页, 欢迎下载使用。
选择性必修1第一节 化学反应速率精品教学课件ppt: 这是一份选择性必修1第一节 化学反应速率精品教学课件ppt,文件包含《化学反应速率》第二课时课件pptx、《化学反应速率》第二课时教学设计docx等2份课件配套教学资源,其中PPT共26页, 欢迎下载使用。














