










化学第二章 化学反应速率与化学平衡第一节 化学反应速率公开课课件ppt
展开1.通过实验,从宏观上认识温度、浓度、压强和催化剂对化学反应速率的影响。知道化学反应是有历程的,认识基元反应活化能对化学反应速率的影响; 2.能从定性和定量结合的角度,用一定的理论模型说明外界条件改变对化学反应速率的影响
你希望这些反应是加快还是减慢呢?
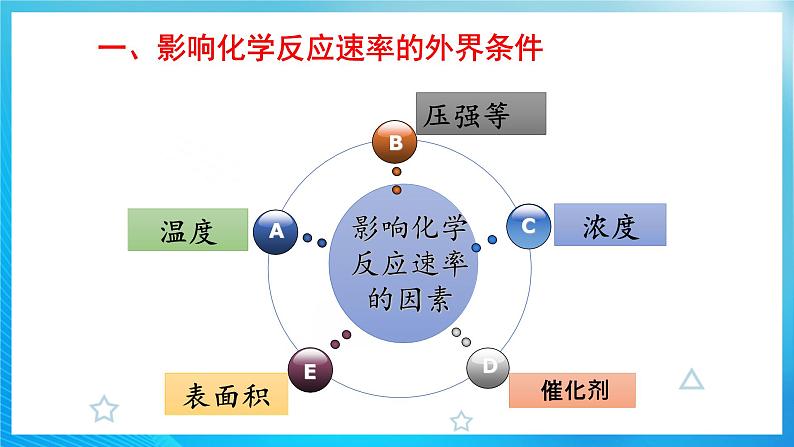
一、影响化学反应速率的外界条件
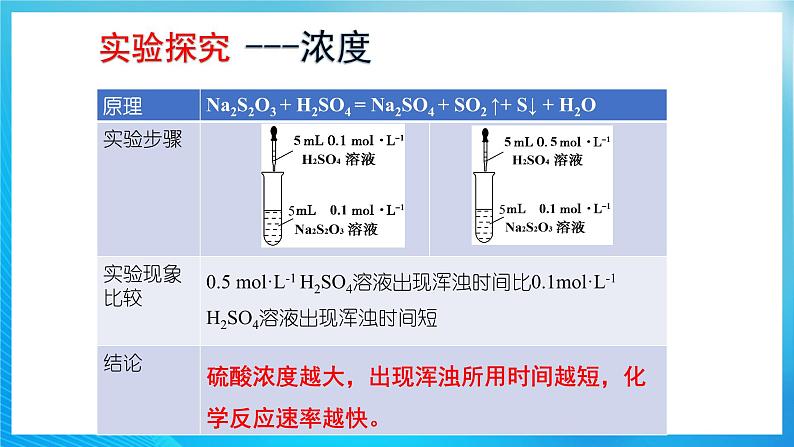
外界条件对化学反应速率影响的深度理解 1.浓度对化学反应速率影响的注意事项(1)固体和纯液体的浓度可视为常数,改变其物质的量,对反应速率无影响。(2)若某物质的浓度变化改变了其性质,反应实质可能发生改变,要具体分析反应速率的变化(如铁与稀硫酸反应,在一定浓度范围内反应速率与浓度有关,但常温下铁遇浓硫酸钝化)。(3)固体物质的反应速率与其表面积有关,颗粒越小,表面积越大,反应速率就越快,故块状固体可通过研磨来增大表面积,从而加快反应速率。(4)对于离子反应,只有实际参加反应的各离子浓度发生变化,才会引起化学反应速率的改变。
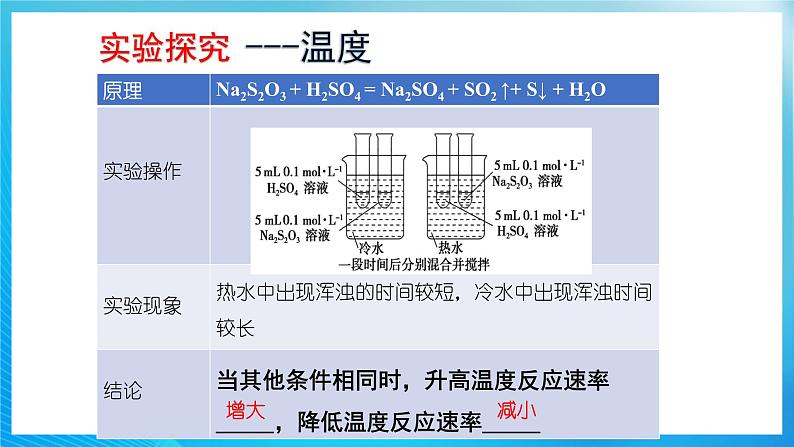
2.温度对化学反应速率影响的注意事项(1)温度对反应速率的影响适用于任何反应,无论是放热反应还是吸热反应,升高温度,反应速率都增大,降低温度,反应速率都减小。(2)对于可逆反应,升高温度,正、逆反应速率都增大,但吸热反应方向的反应速率增大的程度更大;降低温度,正、逆反应速率都减小,但吸热反应方向的反应速率减小的程度更大。(3)大量实验证明,温度每升高10℃,化学反应速率通常增大为原来的2~4倍,利用这一规律可以对一些化学反应速率进行粗略估算。
3.催化剂对化学反应速率影响的注意事项 (1)催化剂只能改变化学反应速率,不能改变反应方向,也不能改变反应热的大小。 (2)同一催化剂能同等程度地改变化学反应的正、逆反应速率。 (3)同一反应,用不同催化剂,反应速率不相同。正催化剂加快化学反应速率,负催化剂减慢化学反应速率(不说明指正催化剂) (4)规律:①选用合适的催化剂,能使反应速率增大。②反应物之间同时发生多个反应时,催化剂有选择性,可以提高目标产物的比率。
针对有气体参加的压强的变化仅由反应容器的容积变化引起的反应,增大压强(减小容器体积)→反应物浓度______→反应速率_____,反之,反应速率_____;对只有固体或纯液体参加的反应,压强变化几乎不影响反应速率。
4、对有气体参加的反应,压强对化学反应速率的影响可简化理解如下
1、设NO+CO2 CO+NO2(正反应吸热)反应速率为v1;N2+3H2 2NH3(正反应放热)反应速率为v2。对于前述反应,当温度升高时,v1和v2变化情况为( ) A、同时增大 B、 同时减小 C、v1减少,v2增大 D、v1增大,v2减小
下列调控反应速率的措施或实验中,分别利用或体现了哪些影响反应速率的因素?(1)向炉膛内鼓风或用煤粉代替煤块可以使炉火更旺。(2)把食物放在冰箱里,在糕点包装内放置除氧剂可以延长食品保质期。(3)做化学实验时,为加速反应的进行,通常将块状或颗粒状的固体药品,研细并混匀或者将固体试剂溶于水配成溶液后再进行实验。(4)铁在空气中和在纯氧中反应的剧烈程度明显不同。
例如 2HI = H2 + I2 是分两步完成的
①2HI→H2 +2I·(自由基) ②2I·→I2
一个化学反应往往经过多个反应步骤才能实现,每一步反应都称为 。
像上述反应历程中的I•一样,带有单电子的原子或原子团叫自由基,如O•自由基。
能够发生化学反应的碰撞
不能够发生化学反应的碰撞
b.碰撞时的取向不合适
活化能越小,普通分子就越 变成活化分子。
如上图所示:E1表示反应的 ;E2表示活化分子变成生成物分子 ;E1-E2表示 。
在一定条件下,活化分子所占的百分数是固定不变的,活化分子的百分数越大,单位体积内 越多,单位时间内 的次数越多,化学反应速率就越快。
6、活化能与反应速率的关系
7、运用有效碰撞理论解释外界条件对化学反应速率的影响
(1)运用有效碰撞理论解释浓度对化学反应速率的影响:①规律:当其他条件不变时,增大反应物的浓度,反应速率加快;反之,反应速率减慢。②理论解释:
(2)运用有效碰撞理论解释温度对化学反应速率的影响:①规律:当其他条件不变时,升高温度,反应速率加快;反之,反应速率减慢。②理论解释:
本质原因:升高温度,一部分非活化分子吸收能量转化为活化分子,使得活化分子百分数提高,活化分子间的有效碰撞频率变大,故反应速率增大。
(3)运用有效碰撞理论解释催化剂对化学反应速率的影响:①规律:当其他条件不变时,使用适当的催化剂,较大程度地增大化学反应速率。②理论解释:
(4)运用有效碰撞理论解释压强对化学反应速率的影响:①规律:当其他条件不变时,对于有气体参加的反应,增大压强(减少容器的容积)相当于增大反应浓度,反应速率加快;减小压强(增大容器的容积)相当于减小反应浓度,反应速率减慢。②理论解释:
注意:①活化分子数变,反应速率不一定变;但活化分子百分数变,则反应速率一定变。②对于可逆反应,升温、加压,加入催化剂既加快正反应速率又加快逆反应速率。
化学选择性必修1第一节 化学反应速率精品课件ppt: 这是一份化学选择性必修1第一节 化学反应速率精品课件ppt,文件包含212活化能练习解析版docx、212活化能练习原卷版docx等2份课件配套教学资源,其中PPT共0页, 欢迎下载使用。
人教版 (2019)选择性必修1第一节 化学反应速率一等奖ppt课件: 这是一份人教版 (2019)选择性必修1第一节 化学反应速率一等奖ppt课件,文件包含人教版高中化学选择性必修一212《活化能》课件pptx、人教版高中化学选择性必修一212《活化能》学案docx等2份课件配套教学资源,其中PPT共28页, 欢迎下载使用。
人教版 (2019)选择性必修1第一节 化学反应速率精品ppt课件: 这是一份人教版 (2019)选择性必修1第一节 化学反应速率精品ppt课件,共25页。PPT课件主要包含了基础巩固,能力提升等内容,欢迎下载使用。












