








人教版九年级下册课题1 常见的酸和碱公开课ppt课件
展开第2课时 酸的化学性质
【学习目标】
1.知道稀盐酸和稀硫酸能使指示剂变色。
2.知道稀盐酸、稀硫酸能与活泼金属反应。
3.知道稀盐酸、稀硫酸能与金属氧化物反应。
【学习重点】 酸的通性。
【学习难点】根据实验归纳 酸的通性。
【学习过程】
一、自主学习
1.在不同的酸溶液中都存在相同的阳离子H+,所以酸溶液具有相似的化学性质。
2.酸与酸碱指示剂的作用:酸溶液可以使紫色石蕊溶液变红色,不能使无色酚酞溶液变色。
3.酸溶液能与活泼的金属反应
(1)锌与稀硫酸反应的化学方程式为:Zn+H2SO4===ZnSO4+H2↑。
(2)镁与稀盐酸反应的化学方程式为:Mg+2HCl===MgCl2+H2↑。
(3)铁与稀硫酸反应的化学方程式为:Fe+H2SO4===FeSO4+H2↑。
4.酸溶液能与某些金属氧化物反应
(1)稀硫酸除铁锈的化学方程式为:Fe2O3+3H2SO4===Fe2(SO4)3+3H2O。
(2)稀盐酸除铁锈的化学方程式为:Fe2O3+6HCl===2FeCl3+3H2O。
二、新知导学
知识点 酸的化学性质
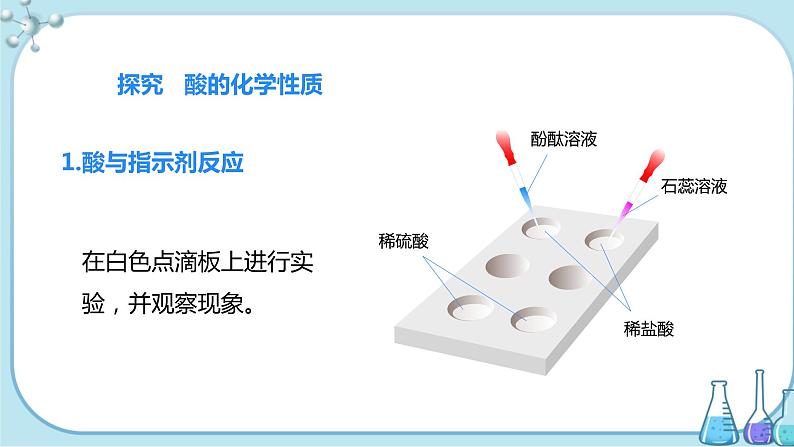
【合作探究一】完成教材P54探究“实验10-7”,在点滴板上进行实验,并观察记录现象。
1.与指示剂作用
| 滴加紫色石蕊溶液 | 滴加无色酚酞溶液 |
稀盐酸 | 红 | 不变色 |
稀硫酸 | 红 | 不变色 |
结论 | 紫色石蕊溶液遇酸变红色,无色酚酞溶液遇酸不变色 | |
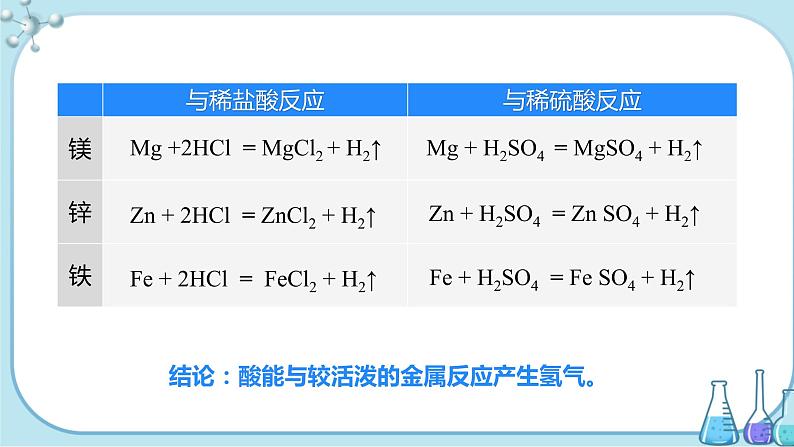
2.与金属反应
【小组讨论】回忆所学的知识,完成下表。
| 与稀盐酸反应的化学方程式 | 与稀硫酸反应的化学方程式 |
镁 | Mg+2HCl===MgCl2+H2↑ | Mg+H2SO4===MgSO4+H2↑ |
铁 | Fe+2HCl===FeCl2+H2↑ | Fe+H2SO4===FeSO4+H2↑ |
锌 | Zn+2HCl===ZnCl2+H2↑ | Zn+H2SO4===ZnSO4+H2↑ |
3.酸与金属氧化物的反应
【合作探究二】完成教材P54“探究”,并观察记录现象。
| 现象 | 化学方程式 |
铁锈+盐酸 | 铁锈逐渐消失,溶液由无色变为黄色 | Fe2O3+6HCl===2FeCl3+3H2O |
铁锈+稀硫酸 | 铁锈逐渐消失,溶液由无色变为黄色 | Fe2O3+3H2SO4===Fe2(SO4)3+3H2O |
4.总结:酸的通性
(1)酸能和酸碱指示剂反应,如能使紫色石蕊变红,不能使无色酚酞溶液变色。
(2)酸能与活泼金属反应生成氢气。
(3)酸能与金属氧化物反应生成水。
(4)酸还能与其他物质反应,如:2HCl+CaCO3===CaCl2+CO2↑+H2O;2HCl+Na2CO3===2NaCl+CO2↑+H2O
三、我的收获
四、当堂检测
1.下列金属不能与酸反应生成氢气的是( D )
A.Mg B.Al C.Fe D.Cu
2.下列变化不能通过加稀盐酸反应实现的是( B )
A.Al→AlCl3 B.Fe2O3→FeCl2 C.CaCO3→CaCl2 D.Fe→FeCl2
3.表面生锈的铁钉放入足量的盐酸中,铁钉逐渐消失,无色溶液逐渐变成黄色。过一段时间以后看到铁钉表面冒气泡,写出铁锈消失的化学反应方程式:Fe2O3+6HCl===2FeCl3+3H2O。
4.烧水的铝壶中常结有一层水垢(该水垢的主要成分是CaCO3),用适量稀盐酸可以除去它,反应的化学方程式是CaCO3+2HCl===CaCl2+CO2↑+H2O。若盐酸的用量过多,会产生不良后果,用化学方程式可表示为2Al+6HCl===2AlCl3+3H2↑。
5.如图表示化学反应中溶液的颜色变化,请回答下列问题。
(1)若X是稀硫酸,a可能是指示剂紫色石蕊溶液。
(2)若X是稀硫酸,写出符合②的一个化学方程式:Fe2O3+3H2SO4 ===
Fe2(SO4)3+3H2O。请写出符合④的一个化学方程式:Fe+2HCl===FeCl2+H2↑。
(3)酸溶液有相似化学性质的原因是溶液中都含有H+ (填离子符号)。
(4)若X是稀盐酸,则d不可能(选填“可能”或“不可能”)是单质, 写出符合③的一个化学方程式: CuO+2HCl===CuCl2+H2O。
人教版九年级下册课题2 酸和碱的中和反应试讲课课件ppt: 这是一份人教版九年级下册课题2 酸和碱的中和反应试讲课课件ppt,文件包含第1课时中和反应pptx、第1课时中和反应docx、第1课时中和反应学用docx、第1课时中和反应docx、实验10-8氢氧化钠溶液与稀盐酸反应mp4等5份课件配套教学资源,其中PPT共20页, 欢迎下载使用。
初中化学人教版九年级下册课题1 常见的酸和碱获奖ppt课件: 这是一份初中化学人教版九年级下册课题1 常见的酸和碱获奖ppt课件,文件包含第3课时常见的碱碱的化学性质pptx、第3课时常见的碱碱的化学性质docx、第3课时常见的碱碱的化学性质docx、第3课时常见的碱碱的化学性质学用docx、实验10-5探究氢氧化钠的物理性质mp4、实验10-6氢氧化钙的性质mp4、实验10-7溶液的导电性mp4等7份课件配套教学资源,其中PPT共23页, 欢迎下载使用。
化学九年级下册课题1 常见的酸和碱精品ppt课件: 这是一份化学九年级下册课题1 常见的酸和碱精品ppt课件,文件包含第1课时酸碱指示剂几种常见的酸pptx、第1课时酸碱指示剂常见的酸docx、第1课时酸碱指示剂几种常见的酸docx、第1课时酸碱指示剂几种常见的酸学用docx、实验10-1指示剂在酸碱溶液中的显色反应mp4、实验10-2盐酸和硫酸的物理性质的比较mp4、实验10-3浓硫酸的腐蚀性mp4、实验10-4浓硫酸的稀释mp4、探究自制酸碱指示剂mp4等9份课件配套教学资源,其中PPT共27页, 欢迎下载使用。













