








高中人教版 (2019)第二节 反应热的计算习题ppt课件
展开第1章 第2节
A组·基础达标
1.在298 K、101 kPa时,已知:
①2H2O(g)===O2(g)+2H2(g) ΔH1
②Cl2(g)+H2(g)===2HCl(g) ΔH2
③2Cl2(g)+2H2O(g)===4HCl(g)+O2(g) ΔH3
则ΔH3与ΔH1和ΔH2间的关系正确的是( )
A.ΔH3=ΔH1+2ΔH2 B.ΔH3=ΔH1+ΔH2
C.ΔH3=ΔH1-2ΔH2 D.ΔH3=ΔH1-ΔH2
【答案】A
2.已知H—H、H—O和O=O键的键能分别为436 kJ·mol-1、463 kJ·mol-1和495 kJ·mol-1。下列热化学方程式正确的是( )
A.H2O(g)===H2(g)+O2(g) ΔH=-485 kJ·mol-1
B.H2O(g)===H2(g)+O2(g) ΔH=+485 kJ·mol-1
C.2H2(g)+O2(g)===2H2O(g) ΔH=+485 kJ·mol-1
D.2H2(g)+O2(g)===2H2O(g) ΔH=-485 kJ·mol-1
【答案】D
3.根据下列热化学方程式:
①C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol-1
②H2(g)+O2(g)===H2O(l) ΔH=-285.8 kJ·mol-1
③CH3COOH(l)+2O2(g)===2CO2(g)+2H2O(l) ΔH=-870.3 kJ·mol-1
可以计算出2C(s)+2H2(g)+O2(g)===CH3COOH(l)的反应热为( )
A.ΔH=+244.1 kJ·mol-1
B.ΔH=-488.3 kJ·mol-1
C.ΔH=-996.6 kJ·mol-1
D.ΔH=+996.6 kJ·mol-1
4.已知甲烷、氢气、一氧化碳的燃烧热ΔH依次为-a kJ·mol-1、-b kJ·mol-1、-c kJ·mol-1(a、b、c均大于0)。可利用甲烷与二氧化碳或水反应制备CO和H2:CH4(g)+CO2(g)===2CO(g)+2H2(g) ΔH1、CH4(g)+H2O(l)===CO(g)+3H2(g) ΔH2。试推算( )
A.ΔH1=(a-2b+2c)kJ·mol-1
B.ΔH1=(b+c-2a)kJ·mol-1
C.ΔH2=(b+3c-a)kJ·mol-1
D.ΔH2=(3b+c-a)kJ·mol-1
【答案】D
5.在一定条件下,CO和CH4燃烧的热化学方程式分别为:
2CO(g)+O2(g)===2CO2(g) ΔH=-566 kJ·mol-1
CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=-890 kJ·mol-1
又知由H2(g)与O2(g)反应生成1 mol液态H2O比生成1 mol气态H2O多放出44 kJ的热量。则CH4气体在空气中不完全燃烧的热化学方程式正确的是( )
A.2CH4(g)+O2(g)===CO2(g)+CO(g)+4H2O(l) ΔH=-1 214 kJ·mol-1
B.2CH4(g)+O2(g)===CO2(g)+CO(g)+4H2O(g) ΔH=-1 038 kJ·mol-1
C.3CH4(g)+5O2(g)===CO2(g)+2CO(g)+6H2O(l) ΔH=-1 538 kJ·mol-1
D.3CH4(g)+5O2(g)===CO2(g)+2CO(g)+6H2O(g) ΔH=-1 840 kJ·mol-1
【答案】D
6.依据题意,写出下列反应的热化学方程式。
(1)在25 ℃、101 kPa条件下,1 g甲醇燃烧生成CO2和液态水时放热22.68 kJ。则表示甲醇燃烧热的热化学方程式为______________。
(2)若适量的N2和O2完全反应生成NO2,每生成23 g NO2需要吸收16.95 kJ热量。则该反应的热化学方程式为______________。
(3)用NA表示阿伏加德罗常数的值,在C2H2(气态)完全燃烧生成CO2和液态水的反应中,每有5NA个电子转移时,放出650 kJ的热量。则该反应的热化学方程式为________________________________。
(4)已知拆开1 mol H—H、1 mol N—H、1 mol N≡N分别需要的能量是436 kJ、391 kJ、946 kJ,则N2与H2反应生成NH3的热化学方程式为________________________________。
【答案】(1)CH3OH(l)+O2(g)===CO2(g)+2H2O(l) ΔH=-725.76 kJ·mol-1
(2)N2(g)+2O2(g)===2NO2(g) ΔH=+67.8 kJ·mol-1
(3)C2H2(g)+O2(g)===2CO2(g)+H2O(l) ΔH=-1 300 kJ·mol-1
(4)N2(g)+3H2(g)2NH3(g) ΔH=-92 kJ·mol-1
7.已知:
(1)CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1
(2)H2(g)+O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1
(3)H2(g)+O2(g)===H2O(l) ΔH=-285.8 kJ·mol-1
常温常压下取体积比为4∶1的甲烷和氢气的混合气体,其体积折合成标准状况下为11.2 L,完全燃烧后,恢复到常温,放出的热量是____________。
【答案】384.7 kJ
8.将煤转化为水煤气的主要化学反应为C(s)+H2O(g)CO(g)+H2(g);C(s)、CO(g)和H2(g)完全燃烧的热化学方程式为
①C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol-1
②H2(g)+O2(g)===H2O(g) ΔH=-242.0 kJ·mol-1
③CO(g)+O2(g)===CO2(g) ΔH=-283.0 kJ·mol-1
请回答:
(1)根据以上数据,写出C(s)与水蒸气反应生成CO和H2的热化学方程式:_________________________________________________________________。
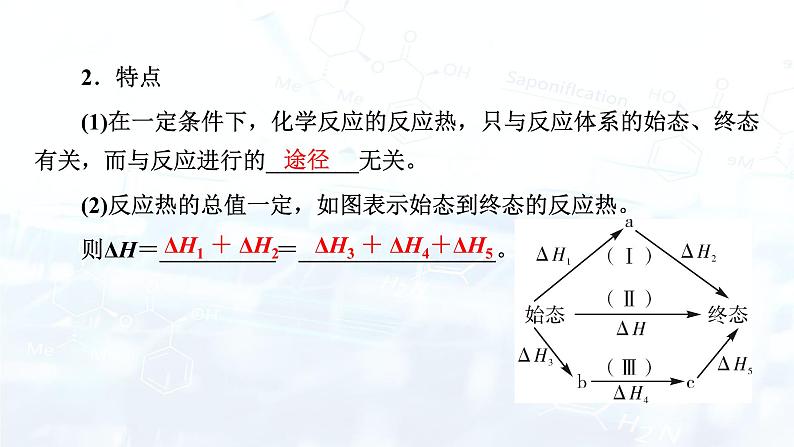
(2)比较反应热数据可知,1 mol CO(g)和1 mol H2(g)完全燃烧放出的热量之和比1 mol C(s)完全燃烧放出的热量多。甲同学据此认为“煤转化为水煤气可以使煤燃烧放出更多的热量”;乙同学根据盖斯定律做出下列循环图:
并据此认为“煤转化为水煤气再燃烧放出的热量与煤直接燃烧放出的热量相等”。
请分析:甲、乙两同学观点中正确的是________(填“甲”或“乙”);判断的理由是__________________________________________。
(3)将煤转化为水煤气作为燃料与煤直接燃烧相比有很多优点,请列举其中的两个优点:____________________________。
【答案】(1)C(s)+H2O(g)===CO(g)+H2(g)
ΔH=+131.5 kJ·mol-1
(2)乙 甲同学忽略了煤转化为水煤气要吸收热量(或ΔH1=ΔH2+ΔH3,且ΔH2>0)
(3)①减少污染,②燃烧充分,③方便运输(答两点即可)
B组·能力提升
9.一定条件下,用甲烷可以消除氮的氧化物(NOx)的污染。已知:①CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ· mol-1,②CH4(g)+4NO(g)===2N2(g)+CO2(g)+2H2O(g) ΔH2=-1 160 kJ· mol-1。下列选项不正确的是( )
A.CH4(g)+2NO2(g)===N2(g)+CO2(g)+2H2O(g)
ΔH=-867 kJ· mol-1
B.CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(l)
ΔH3<ΔH1
C.若用0.2 mol CH4(g)还原NO2(g)至N2(g),则反应中放出的热量一定为173.4 kJ
D.若用标况下2.24 L CH4还原NO2至N2,整个过程中转移电子的物质的量为0.8 mol
【答案】C
10.已知:H2O(g)===H2O(l) ΔH1
C6H12O6(g)===C6H12O6(s) ΔH2
C6H12O6(s)+6O2(g)===6H2O(g)+6CO2(g) ΔH3
C6H12O6(g)+6O2(g)===6H2O(l)+6CO2(g) ΔH4
下列说法正确的是( )
A.ΔH1<0,ΔH2<0,ΔH3<ΔH4
B.6ΔH1+ΔH2+ΔH3-ΔH4=0
C.-6ΔH1+ΔH2+ΔH3-ΔH4=0
D.-6ΔH1+ΔH2-ΔH3+ΔH4=0
【答案】B
11.已知H2(g)+Br2(l)===2HBr(g) ΔH=-72 kJ·mol-1,蒸发1 mol Br2(l)需要吸收的能量为30 kJ,其他相关数据如下表:
物质 | H2(g) | Br2(g) | HBr(g) |
1 mol分子中的化学键断裂时需要吸收的能量/kJ | 436 | a | 369 |
则下列说法正确的是( )
A.2HBr(g)===H2(g)+Br2(l) ΔH<0
B.Br2(l)===Br2(g) ΔH=-30 kJ·mol-1
C.H2(g)+Br2(g)===2HBr(g) ΔH=-42 kJ·mol-1
D.a=200
【答案】D
12.MgCO3和CaCO3的能量关系如图所示(M=Ca、Mg):
M2+(g)+CO(g)M2+(g)+O2-(g)+CO2(g)
↑ΔH1 ↓ΔH3
MCO3(s) MO(s)+CO2(g)
已知:离子电荷相同时,半径越小,离子键越强。下列说法不正确的是( )
A. ΔH1(MgCO3)>ΔH1(CaCO3)>0
B.ΔH2(MgCO3)=ΔH2(CaCO3)>0
C.ΔH1(CaCO3)-ΔH1(MgCO3)=ΔH3(CaO)-ΔH3(MgO)
D.对于MgCO3和CaCO3,ΔH1+ΔH2>ΔH3
【答案】C
13.红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g),反应过程中的能量关系如图所示(图中的ΔH表示生成1 mol产物的数据)。
根据图像回答下列问题:
(1)P(s)和Cl2(g)反应生成PCl3(g)的热化学方程式是______________。
(2)PCl5(g)分解成PCl3(g)和Cl2(g)的热化学方程式是______________。
(3)P(s)和Cl2(g)分两步反应生成1 mol PCl5(g)的ΔH3=________,P(s)和Cl2(g)一步反应生成1 mol PCl5(g)的ΔH4________(填“大于”“小于”或“等于”)ΔH3。
【答案】(1)Cl2(g)+P(s)===PCl3(g) ΔH=-306 kJ/mol (2)PCl5(g)===PCl3(g)+Cl2(g) ΔH=+93 kJ/mol
(3)-399 kJ/mol 等于
14.断开1 mol AB(g)分子中的化学键使其分别生成气态A原子和气态B原子所吸收的能量称为A—B的键能。下表列出了一些化学键的键能(E):
化学键 | H—H | Cl—Cl | O===O | C—Cl | C—H | O—H | H—Cl |
E/(kJ·mol-1) | 436 | 247 | x | 330 | 413 | 463 | 431 |
请回答下列问题:
(1)如图表示某反应的能量变化关系,则此反应为____________(填“吸热”或“放热”)反应,其中ΔH=______________(用含有a、b的关系式表示)。
(2)若图示中表示反应H2(g)+O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1,则根据所给键能数据可得,b=________ kJ·mol-1,x=________。
(3)历史上曾用“地康法”制氯气,这一方法是用CuCl2作催化剂,在450 ℃时利用空气中的氧气与氯化氢反应制氯气。反应的化学方程式为________________________ ____________。若忽略温度和压强对反应热的影响,根据题给有关数据及前面的计算结果,计算当反应中有1 mol电子转移时,反应的能量变化为____________________。
【答案】(1)放热 (a-b) kJ·mol-1
(2)926 496.4
(3)O2+4HCl2Cl2+2H2O 放出31.4 kJ能量
高中化学人教版 (2019)选择性必修1第二节 反应热的计算教学演示课件ppt: 这是一份高中化学人教版 (2019)选择性必修1第二节 反应热的计算教学演示课件ppt,共42页。PPT课件主要包含了目录索引,探究一盖斯定律,探究二反应热的计算等内容,欢迎下载使用。
化学选择性必修1第二节 反应热的计算作业ppt课件: 这是一份化学选择性必修1第二节 反应热的计算作业ppt课件,共38页。PPT课件主要包含了bc+d-2a,a-2b等内容,欢迎下载使用。
选择性必修1第二节 反应热的计算习题ppt课件: 这是一份选择性必修1第二节 反应热的计算习题ppt课件,文件包含反应热的计算pptx、反应热的计算-练习题docx等2份课件配套教学资源,其中PPT共22页, 欢迎下载使用。














