





高中化学必修一 专题4.3.2 共价键
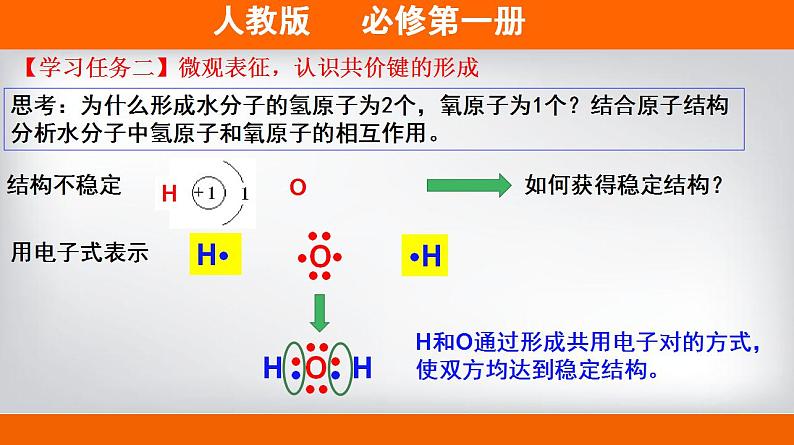
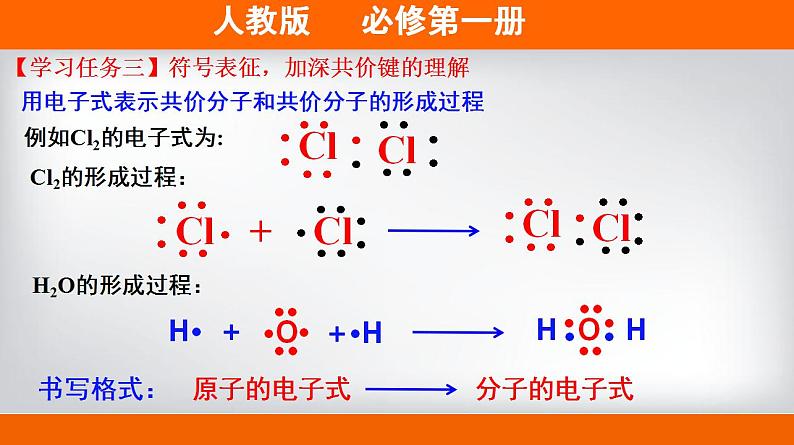
展开第四章 物质结构 元素周期律 第三节 化学键第2课时 共价键 H2O(l) 100℃ H2O(g) 2000℃ H2(g)+O2(g)【情景创设】通常情况下,水加热至100℃时可以变为水蒸气;加热至2000℃或通电时才能解离成氢气和氧气。这说明了什么?结论:水分子内部的氢原子和氧原子之间存在相互作用。物理变化(物质的聚集状态发生变化)化学变化(原子重新组合)【学习任务一】宏观辨识,感受化学键的存在思考:为什么形成水分子的氢原子为2个,氧原子为1个?结合原子结构分析水分子中氢原子和氧原子的相互作用。结构不稳定如何获得稳定结构?H··H用电子式表示H和O通过形成共用电子对的方式,使双方均达到稳定结构。【学习任务二】微观表征,认识共价键的形成原子间通过共用电子对所形成的相互作用称为共价键【新概念】共价键成键粒子:成键本质:成键元素:原子共用电子对形成的相互作用非金属元素间(一般)或某些不活泼金属和非金属间共价键哪些物质中存在共价键,请举例说明。H2、O2、Cl2、CO2、H2O、HF、OH-、SO42-、NH4+等等。多原子单质分子、非金属氧化物、非金属氢化物、带电原子团等【思考】同种元素原子吸引电子能力相同,共用电子对不偏向任何一个原子,成键的原子因此而不显电性。不同种元素原子吸引电子的能力不相同,共用电子对偏向吸引电子能力强的一方,所 以吸引电子 能力强的原子一方显负电性 ,吸引电子能力弱的原子一 方显正电性。共价键的类型非极性键极性键例如H2、O2、Cl2,原子化合价为0。例如HCl,Cl原子吸引共用电子对能力更强,故显-1价,氢显+1价。由同种元素原子形成的共价键和不同种元素形成的共价键有什么区别?(提示:共用电子对是否发生偏移)下列物质是否含有共价键,如果有,请指明共价键的类型。①N2 ②CO2 ③CH4 ④Na2O2⑤NaOH ⑥H2O2 ⑦NH4Cl【学习评价】【学习评价】下列物质中存在共价键的是______________________________;属于共价化合物的是____________________________。H2、MgO、Cl2、CO2、HF、NaOH、H2O、Na2SO4、NH4Cl【新概念】共价化合物共价化合物:以共用电子对形成分子的化合物。换一句话说:“只含有共价键的化合物为共价化合物。”稀有气体中存在共价键吗?易错警醒:既有离子键又有共价键的化合物属于离子化合物。例如Cl2的电子式为:用电子式表示共价分子和共价分子的形成过程Cl2的形成过程:原子的电子式分子的电子式书写格式:H2O的形成过程:【学习任务三】符号表征,加深共价键的理解写出①、②、③的电子式,并用电子式表示④、⑤其形成过程。①CO2______________________②N2________________________③CCl4______________________④NH3__________________________________________________________⑤HF_____________________________________________________【学习评价】【拓展】在化学上,常用一根短线 “—”表示1对共用电子,如氯分子可以表示 为Cl-C1。 这种图示叫做结构式。直线型V型正四面体空间结构化学反应的本质:旧化学键断裂和新化学键形成从化学键的角度认识化学反应例如:化学键——相邻的原子之间强烈的相互作用。化学键的形成与原子结构有关,它主要通过原子的价电子间的转移或共用来实现。两种相同或不同的非金属元素之间 原 子阴、阳离子电子得失形成共用电子对活泼金属与活泼非金属【整理归纳】含有离子键的化合物只含有共价键的化合物强碱、绝大多数盐、活泼金属氧化物非金属氢化物、非金属氧化物、含氧酸、大多数有机物NaOH、Na2O、Na2SO4、NH4ClHF、CO2、HNO3、C2H5OH【整理归纳】离子化合物和共价化合物共价化合物离子化合物1、下列化学键的说法中,不正确的是( )A.化学键是一种作用力B.化学键可以使离子相结合,也可以使原子相结合C.化学反应过程中,反应物分子内的化学键断裂,产物分子中化学键形成D.非极性键不是化学键【学习评价】教材P110 第4题答案:选D.2.下列变化中,不需要破坏化学键的是( ) A.加热氯化铵 B.干冰气化 C.食盐溶于水 D.氯化氢溶于水答案:选B.干冰气化破坏分子间作用力 【学习评价】【拓展】分子间作用力(范德华力和氢键)分子间作用力:把分子聚集在一起的作用力。对物质的熔点、沸点等有影响。教材P110 资料卡片化学键>分子间作用力根据上述物质的变化过程,你能比较出分子间作用力和化学键的强弱吗?氢键是怎样形成的?FHOHOHOH共价键氢键d-d+d-d+d-d+d-d+(静电吸引作用)HHd+d+氢键也是一种分子间作用力,它比化学键弱,但比范德华力强,氢键会使物质的熔点和沸点升高。形成氢键的分子:HF、H20、NH3右图为某些氢化物的沸点。你能找出其中的规律吗? 周期有氢键,反常高。无氢键,看分子间作用力。相对分子质量越大,分子间作用力越大,物质的熔点、沸点越高! 下列现象与氢键有关的是 ①NH3的熔、沸点比ⅤA族其他元素氢化物的高 ②NH3极易溶于水 ③冰的密度比液态水的密度小 ④水分子高温下很稳定 A.①②③④ B.①②③ C.①② D.①③B解析:④水分子高温下很稳定是因为分子中O—H键的键能大,很稳定。【学习评价】
人教版 (2019)必修 第一册第三节 化学键教学ppt课件: 这是一份人教版 (2019)必修 第一册第三节 化学键教学ppt课件,共39页。PPT课件主要包含了素养要求,共价分子的表示方法,NaOH电子式,NH4Cl电子式,当堂练习等内容,欢迎下载使用。
高中化学人教版 (2019)必修 第一册第四章 物质结构 元素周期律第三节 化学键教学课件ppt: 这是一份高中化学人教版 (2019)必修 第一册第四章 物质结构 元素周期律第三节 化学键教学课件ppt,共10页。PPT课件主要包含了情景引入,HCl,电子对不偏移,电子对偏向Cl,非极性共价键,极性共价键,共价键,共用电子对,共价化合物,只含共价键等内容,欢迎下载使用。
人教版 (2019)选择性必修1第四章 化学反应与电能第三节 金属的腐蚀与防护获奖课件ppt: 这是一份人教版 (2019)选择性必修1第四章 化学反应与电能第三节 金属的腐蚀与防护获奖课件ppt,文件包含432金属的防护练习解析版docx、432金属的防护练习原卷版docx等2份课件配套教学资源,其中PPT共0页, 欢迎下载使用。













