



- 4.1.3 原子结构与元素性质(教学课件) 课件 0 次下载
- 4.2.1 元素性质的周期性变化规律(教学课件) 课件 0 次下载
- 4.2.2 元素周期表和元素周期律的应用(教学课件) 课件 0 次下载
- 4.3.1 离子键(教学课件) 课件 1 次下载
- 4.3.3 化学键+分子间作用力(教学课件) 课件 0 次下载
人教版 (2019)必修 第一册第三节 化学键教学ppt课件
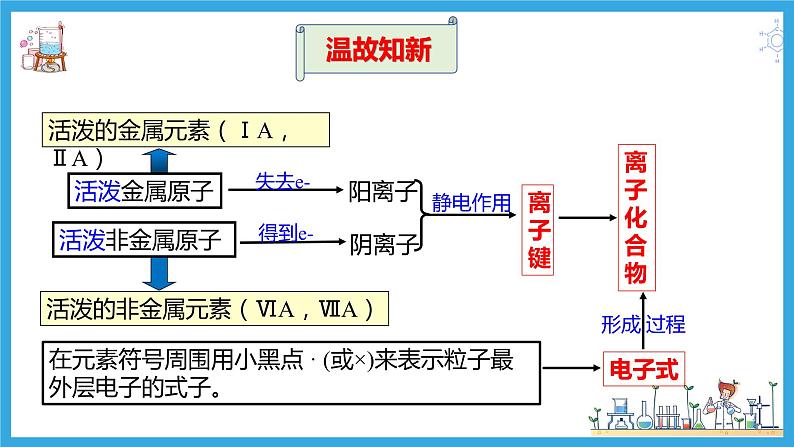
展开【温故知新】离子键和离子化合物
第二课时 共价键
第四章 物质结构 元素周期律第三节 化学键
1.了解共价键、极性键、非极性键的概念,会用电子式表示共价键的形成过程。2.会识别与判断共价化合物,熟知分子结构不同的表示方法。3.了解化学键的概念及化学反应的实质。
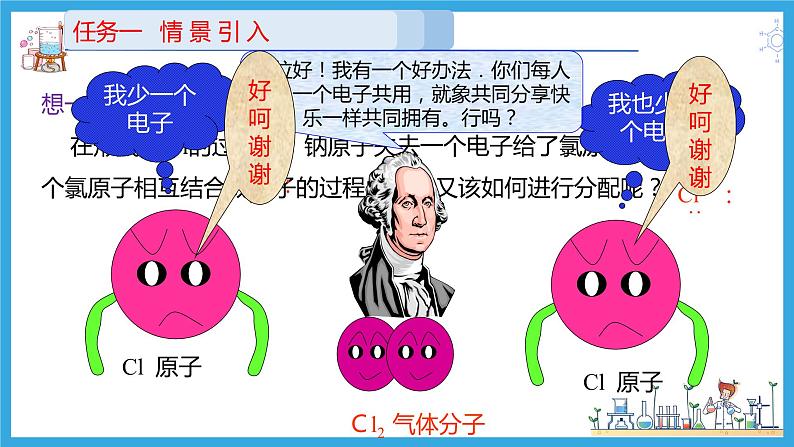
想一想: 在形成NaCl的过程中,钠原子失去一个电子给了氯原子,那当两个氯原子相互结合成分子的过程中电子又该如何进行分配呢?
二位好!我有一个好办法.你们每人拿出一个电子共用,就象共同分享快乐一样共同拥有。行吗?
为什么2个氢原子结合成氢分子,2个氯原子结合成氯分子,而不是3个、4个呢?为什么1个氢原子和1个氯原子结合成氯化氢分子,而不是以其他的个数比相结合呢?
共价键 共价化合物
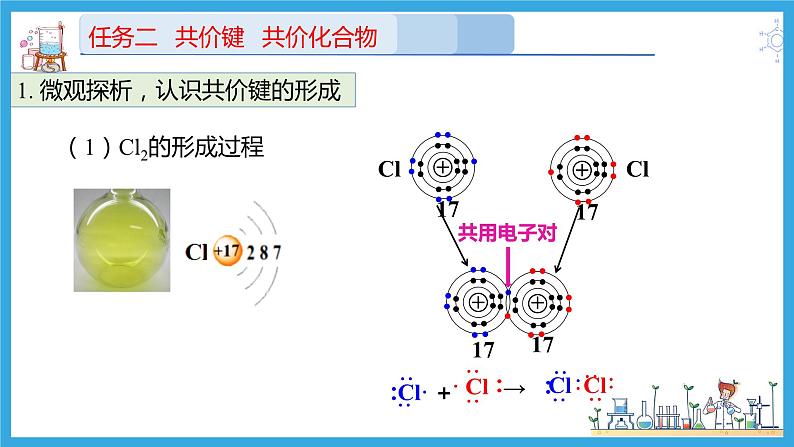
1. 微观探析,认识共价键的形成
(1)Cl2的形成过程
(2)HCl的形成过程
原子间通过共用电子对形成的稳定的相互作用力
②部分金属元素与非金属元素之间(eg:AlCl3)
①非金属元素原子之间相结合
Cl2、CCl4、H2O、HF、HNO3、CO2
原子间通过共用电子对相结合,使各原子最外层电子趋于稳定结构,原子形成分子后,体系的总能量降低。
注意:稀有气体单质中不存在共价键
如H2、Cl2、CO2、H2O、NH4+ 、OH-等。
分析: 非金属元素的原子均有获得电子的倾向。
(1)存在于多原子非金属单质和共价化合物(2)存在于某些离子化合物(含带电子原子团的离子化合物)中
分开后,她们为什么不高兴?让我们听听她们说些什么?
我只有一个电子,太少了
H2+Cl2===2HCl
一方显正电性,一方显负电性。
H2、N2、O3、Cl2
HCl、NO2、H2O
吸引电子能力强的原子显负电吸引电子能力弱的原子显正电
【归纳对比】极性共价键与非极性共价键
思考与交流:我们把含有离子键的化合物称为离子化合物,那含有共价键的化合物称为什么?共价键存在于哪些物质中呢?
只含共价键的化合物叫共价化合物
(2)常见共价化合物:
①酸分子 ②非金属氧化物(包括非金属氧化物)③非金属氢化物(包括有机物) ④多原子非金属单质 ⑤少部分盐(eg:AlCl3、BeCl2)
离子化合物和共价化合物的本质区别: 离子化合物在熔融时能导电,共价化合物在熔融时不能导电
(1)共价键与离子键的成键微粒是一样的( )(2)非金属元素只能形成共价键( )(3)单质分子中一定含共价键( )(4)H2O2中既有极性键,又含有非极性键( )(5)只由非金属元素组成的化合物一定是共价化合物( )
3.(2022·广东肇庆高一期末)研究化学键有助于人们理解物质的某些性质,下列物质既含离子键又含共价键的是( )A.CaCl2 B.CO2 C.H2SO4 D.K2O2
2、下列化合物中,只含共价键的是( )A.H2O B.KCl C.CaF2 D.NaOH
(1)书写要求:①不标电荷和中括号 “ [ ] ”②原子最外层电子数距8电子(氢原子满足2电子)稳定结构差几个电子,就提供几个电子,并在此原子周围形成几对共用电子对(即几个共价键)③化合物中原子最外层缺电子最多的元素排在中间; 当共价键中有氢原子时,将氢元素排在最外层
与离子化合物书写的区别
化学上,常用“—”表示一对共用电子,非共用电子省略不标。
规律:共用的电子对数=8-最外层电子数(H除外)
分别用“—、═、≡”表示一对、二对和三对共用电子对
几种常见的以共价键形成的分子及其结构
写出下列微粒或物质的电子式及分类:(1) :______________。 (2)OH-:______________。(3)NH4Cl:___________________,______化合物。
(4)NaOH:__________________,______化合物。(5)H2S:_____________,______化合物。
3、共价化合物的形成过程
注意:(1)→ 左侧相同原子的电子式可以合并(2)原子重新组合的过程没有电子的得失,无需标明电子的去向
练习:用电子式表示下列共价分子的形成过程
【思考】如何感知共价键是真实的存在?
Q吸=918kJ/ml
Q吸=431kJ/ml
Q吸=769kJ/ml
.能证明氯化氢是共价化合物的是( )
A.氯化氢易溶于水B.液态氯化氢不导电C.氯化氢在水中完全电离D.氯化氢比较稳定
判断离子化合物和共价化合物的三种方法
从组成元素的角度判断化学键类型
阴阳离子之间通过静电作用形成的化学键
原子之间通过共用电子对形成的化学键
大多数金属氧化物、碱、盐(离子化合物)
共价化合物、部分离子化合物
一定有离子键,可能有共价键
熔融状态不导电,水溶液部分导电
①含共价键的化合物不一定就是共价化合物,也可能是离子化合物
②含有离子键的物质不一定是共价化合物,也可能是单质
①共价化合物中一定只含有共价键②共价化合物中一定不含有离子键③离子化合物一定含离子键,可能含共价键
思考:NaOH、NH4Cl的电子式?
1、判断下列化合物的类型NaOH、H2S、MgCl2、H2SO4、KNO3、CO2、NH4Cl、AlCl3离子化合物 ;共价化合物 ;含共价键的离子化合物 ;
2.(2022·北京房山区高一期末)下列电子式书写不正确的是( )A. B.C. D.
3.(2022·余姚市校级高一月考)含有极性共价键的盐是( )A.KCl B.H2O2 C.NH4Cl D.Cu2S
4.(2023·徐州高一期末)下列说法正确的是( )A.CaO和SiO2都是离子化合物B.次氯酸的电子式是C.H2O比H2S的沸点高是因为水分子间存在氢键D.含金属元素的化合物一定是离子化合物
高中化学人教版 (2019)必修 第一册第三节 化学键教学ppt课件: 这是一份高中化学人教版 (2019)必修 第一册第三节 化学键教学ppt课件,共20页。PPT课件主要包含了学习目标,共价键,课堂小结等内容,欢迎下载使用。
高中化学人教版 (2019)必修 第一册第三节 化学键评课ppt课件: 这是一份高中化学人教版 (2019)必修 第一册第三节 化学键评课ppt课件,共27页。PPT课件主要包含了氯分子的形成过程,氯化氢分子的形成过程,分子间作用力等内容,欢迎下载使用。
高中化学人教版 (2019)必修 第一册第三节 化学键备课ppt课件: 这是一份高中化学人教版 (2019)必修 第一册第三节 化学键备课ppt课件













