




人教版 (2019)必修 第二册第二节 氮及其化合物教案配套ppt课件
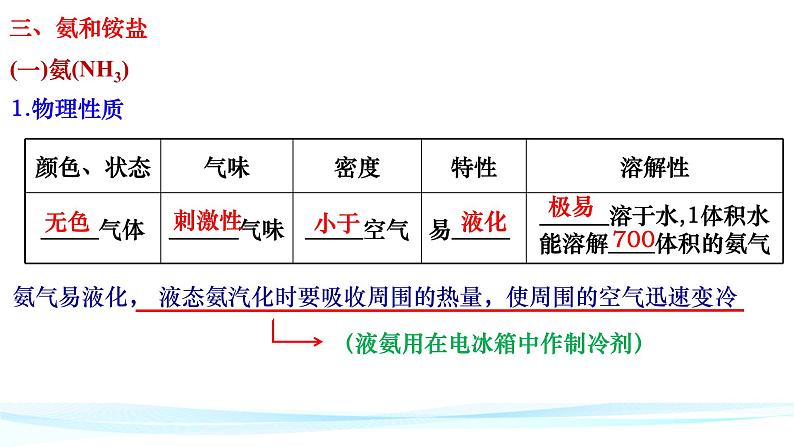
展开氨气易液化, 液态氨汽化时要吸收周围的热量,使周围的空气迅速变冷
(液氨用在电冰箱中作制冷剂)
烧杯里的液体由玻璃管进入烧瓶,形成喷泉;烧瓶中的液体呈红色。
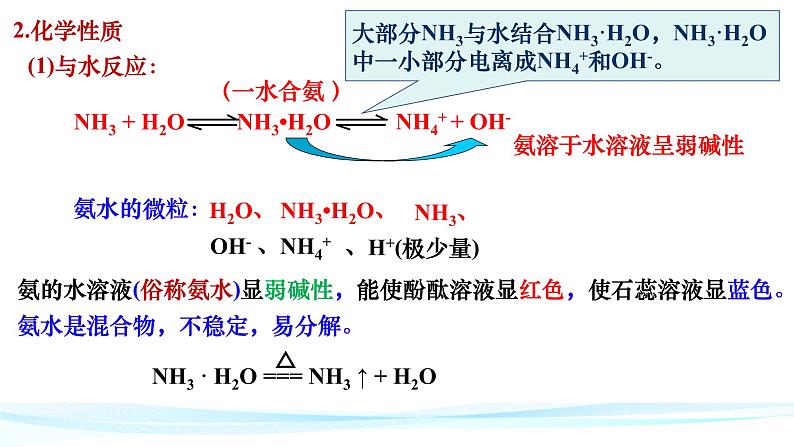
氨气极易溶于水,且生成的水溶液呈碱性。
氨的水溶液(俗称氨水)显弱碱性,能使酚酞溶液显红色,使石蕊溶液显蓝色。氨水是混合物,不稳定,易分解。
OH- 、NH4+
大部分NH3与水结合NH3·H2O,NH3·H2O中一小部分电离成NH4+和OH-。
(2)氨跟氯化氢的反应
沾有浓盐酸和浓氨水的玻璃棒靠近会产生大量白烟
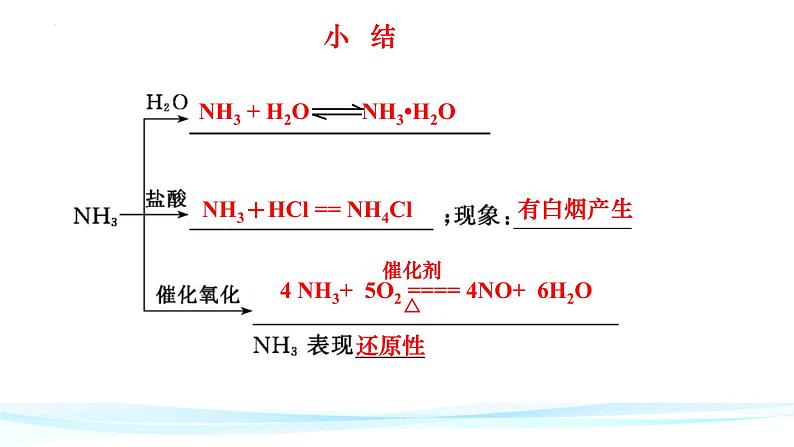
NH3+HCl == NH4Cl
氨的催化氧化是工业上制硝酸的基础。
NH3+HNO3 == NH4NO3
(1)液氨可用作制冷剂,是因为其汽化时吸收大量的热( )(2)氨水呈碱性,是因为NH3溶于水发生反应:NH3+H2O=NH4++OH-( )(3)氨溶于水,溶液可以导电,因此NH3为电解质( )(4)将蘸有浓氨水的玻璃棒靠近浓硫酸有白烟产生( )(5)氨中氮元素的化合价为-3价,在反应中只能升高而具有还原性( )(6)新制饱和氨水中含氮粒子物质的量浓度最大的是 NH4+ ( )
铵盐是农业上常用的化肥,如硫酸铵、碳酸氢铵、硝酸铵等。绝大多数铵盐都易溶于水,受热易分解,与碱反应会放出氨气。
(二)铵盐(NH4+)
2.铵盐与碱反应,生成氨气:
运用:实验室用来制NH3、用于NH4+的检验
(1)铵盐(NH4+) 的检验:
取样品少许于试管中,加入浓NaOH溶液,加热, 将湿润的红色石蕊试纸伸到管口, 试纸变蓝,说明样品是铵盐(含NH 4 + )。
(2)氨的实验室制备:
NH4Cl、Ca(OH)2
思考:用氢氧化钠代替氢氧化钙好吗?
氢氧化钠易吸水,易结块,不易产生NH3;热的氢氧化钠对玻璃有腐蚀作用。
要得到干燥的氨气,常用试剂有哪些?
ⅱ. CaCl 2、浓硫酸不能用来干燥NH3
ⅰ.CaO、 NaOH、碱石灰等碱性干燥剂
ⅰ.用湿润的红色石蕊试纸检验试纸变蓝
ⅱ.用蘸有浓盐酸的玻璃棒检验产生白烟
ⅰ.用吸有水或稀硫酸的棉花塞在管口吸收多余的NH3
ⅱ.用右图防倒装置吸收多余的NH3
除了利用上述方法之外,实验室有无其他简单可行的方法来制得氨气?
方法二:加热浓氨水制氨气
1、CaO(或NaOH)吸收水分,减少溶剂2、CaO(或NaOH)溶解放出热量,升高温度
NH3·H2O + CaO= NH3↑+ Ca(OH) 2
浓氨水与生石灰或氢氧化钠制取
(1)铵盐都易溶于水,且都易分解( )(2)铵盐都不稳定,受热分解都生成NH3( )
(3)向某溶液中加入稀NaOH溶液,湿润的红色石蕊试纸不变蓝,则原溶液中一定无NH4+ ( )(4)NH4Cl受热分解,所以可用加热的方法分离NH4Cl和NaCl( )(5)NH4HCO3受热易分解,因而可用作氮肥( )(6)NH4HCO3与足量NaOH溶液共热时,发生反应的离子方程式为 ( )
(1)某同学根据铵盐受热分解的性质,认为可以采用加热NH4Cl分解的方法来制取氨( )(2)由于氨极易溶于水,所以不能用排水法收集氨,只能用向下排空气法收集( )(3)由于氨极易溶于水,所以多余的氨可以用导管直接插入水中进行吸收( )(4)氨可以用浓硫酸来进行干燥( )(5)为加快产生NH3的速率,实验室可以用NaOH固体和NH4Cl固体反应制NH3( )
1.下列关于氨性质的叙述中正确的是( )A、氨气可用排水法收集 B、氨水成碱性C、氨气和酸相遇都能产生白烟D、在反应NH3+H+=NH4+中,氨失去电子被氧化
2.某同学在实验室中发现了一瓶有刺激性气味的气体,根据气体的判断可能是氨气,但不知是否确实是氨气,下列提供的方法中,你认为能帮他检验是否为氨气的方法是( )A、将湿润的红色石蕊试纸放在瓶口B、将干燥的红色石蕊试纸放在瓶口C、用蘸有浓盐酸的玻璃棒靠近瓶口D、将湿润的蓝色石蕊试纸放在瓶口
思考:1.能将NH4Cl 、(NH4)2SO4、NaCl、 Na2SO4四种溶液一一区别开来的试剂是( )A NaOH B AgNO3 C BaCl2 D Ba(OH)2
2.下列组合能形成明显喷泉并充满烧瓶的是( )
3 .某学生在氨气的喷泉实验基础上积极思考产生喷泉的其他方法,并设计如图所示的装置。在锥形瓶中,分别加入足量的下列物质,反应后可能产生喷泉的是:( )(A)Cu与稀盐酸(B)NaHCO3与NaOH(C)CaCl2与稀硫酸(D)NH4HCO3与稀盐酸
4.A、B、C三种气体,A无色,在一定条件下A能与O2反应生成B,B不溶于水,它能与O2反应生成红棕色气体C;A、C气体均溶与水,其水溶液分别呈碱性与酸性,推断A ,B ,C 。
高中化学人教版 (2019)必修 第二册第二节 氮及其化合物图文ppt课件: 这是一份高中化学人教版 (2019)必修 第二册<a href="/hx/tb_c4000034_t3/?tag_id=26" target="_blank">第二节 氮及其化合物图文ppt课件</a>,共1页。
人教版 (2019)必修 第二册第二节 氮及其化合物授课课件ppt: 这是一份人教版 (2019)必修 第二册第二节 氮及其化合物授课课件ppt,共30页。PPT课件主要包含了化合价,物质类别,氢化物,氧化物,自然固氮,N2的性质,NO的性质,化学性质,NO2的性质,物理性质等内容,欢迎下载使用。
5.2氮及其化合物复习 课件 2021-2022学年高一下学期化学人教版(2019)必修第二册: 这是一份5.2氮及其化合物复习 课件 2021-2022学年高一下学期化学人教版(2019)必修第二册,共1页。













