





还剩52页未读,
继续阅读
成套系列资料,整套一键下载
【2019新人教版化学】(拔高篇)必修二5.1.2(化学) 课件
展开
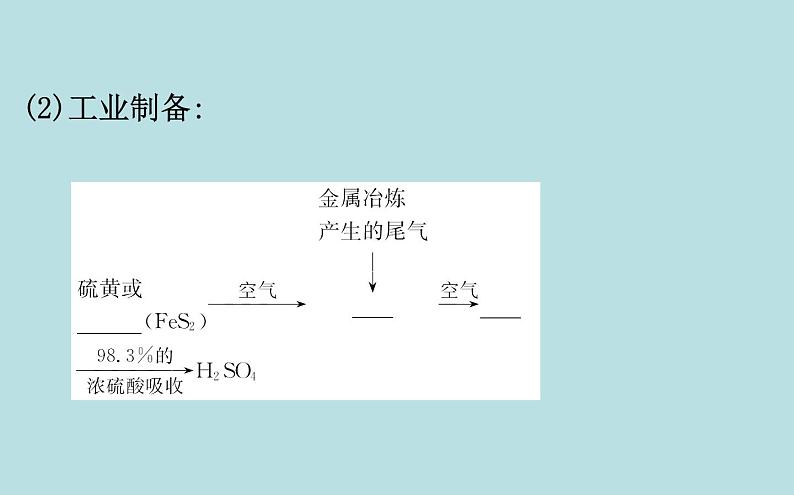
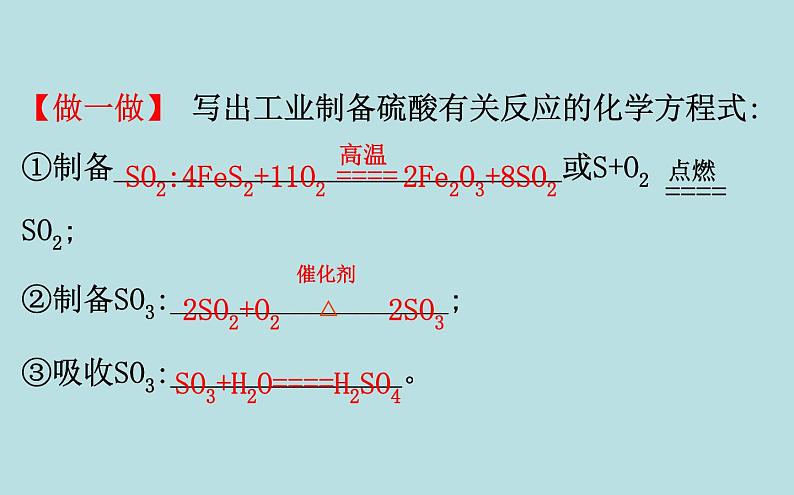
第2课时 硫酸 硫酸根离子的检验一、硫酸1.硫酸的用途与工业制备(1)用途:①重要的化工原料,可用于制___________、炸药、染料、盐类等。②用于精炼石油、金属加工前的酸洗及制取各种挥发性酸、作干燥剂等。化肥、农药(2)工业制备:【做一做】 写出工业制备硫酸有关反应的化学方程式:①制备_____________________________或S+O2 SO2;②制备SO3:__________________;③吸收SO3:_______________。SO2:4FeS2+11O2 2Fe2O3+8SO22SO2+O2 2SO3SO3+H2O====H2SO42.稀硫酸的性质硫酸是强酸,具有酸的通性。【做一做】 写出下列反应的离子方程式:(1)稀硫酸与活泼金属反应,如Zn:__________________。(2)稀硫酸与金属氧化物反应,如CuO:___________________。Zn+2H+====Zn2++H2↑CuO+2H+====Cu2++H2O(3)稀硫酸与碱反应,如NaOH: _____________。(4)稀硫酸与部分盐反应,如Na2CO3: _____________________。OH-+H+====H2O +2H+====CO2↑+H2O3.浓硫酸的特性(1)吸水性与脱水性①实验探究蔗糖变黑,体积膨胀,变成疏松多孔的海绵状的炭,并发出有刺激性气味的气体浓硫酸具有脱水性②对比气体、液体中的水分子氢、氧元素按水的组成比物质中含有H2O物质中不含有H2O,只含有氢元素和氧元素作干燥剂【微思考】浓硫酸能使蓝色胆矾变为白色,该过程体现了浓硫酸的脱水性还是吸水性?提示:体现了吸水性。浓硫酸的吸水性是指浓硫酸吸收水分子(如气体、液体中的水分子,吸收固体中的结晶水等)。(2)强氧化性①实验探究有气泡产生逐渐变为无色紫色石蕊溶液逐渐变为红色溶液显蓝色Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O②强氧化性的表现二、 的检验1.实验探究生成白色沉淀沉淀不溶解生成白色沉淀沉淀不溶解生成白色沉淀沉淀溶解,且有气泡产生白色沉淀 +Ba2+====BaSO4↓2.检验 的正确操作方法:被检液 取清液 有无白色沉淀产生(判断有无 )。先加稀盐酸的目的是_______________________。 防止 、 、Ag+干扰【巧判断】(1)用BaCl2溶液鉴别 和 。 ( )提示:×。BaCl2溶液与 和 反应都生成白色沉淀,要鉴别必须再加入足量盐酸,白色沉淀溶解的为 ,不溶解的为 。(2)稀硫酸没有氧化性,一般不能发生氧化还原反应。 ( )提示:×。稀硫酸中氢元素具有弱氧化性,可以与活泼金属发生氧化还原反应。(3)铜片溶于热的浓硫酸,体现了浓硫酸的酸性和强氧化性。 ( )提示:√。铜片溶于热的浓硫酸,生成硫酸铜和SO2,分别体现了酸性和强氧化性。【情境·思考】现在我们炒菜用的精盐又细又白,你知道精盐是由粗盐经过什么样的程序制得的吗?粗盐经溶解、过滤和蒸发后还含有硫酸盐及CaCl2、MgCl2等杂质,回答下列问题:(1)粗盐中的杂质可以用什么试剂除去?提示:硫酸盐——BaCl2溶液;CaCl2——Na2CO3溶液;MgCl2——NaOH溶液。(2)上述除杂试剂会不会引入新的杂质?如何除去杂质离子?提示:(3)根据以上分析,写出粗盐提纯的完整流程。提示: 知识点一 浓硫酸的强氧化性【重点释疑】1.浓硫酸强氧化性的本质浓硫酸具有强氧化性是因为硫酸分子中+6价的硫元素具有很强的得电子能力。2.浓硫酸强氧化性的体现3.区分浓硫酸和稀硫酸的方法【思考·讨论】 (1)过量的铜与一定量的浓硫酸反应时,硫酸能否全部参加反应?提示:不能。Cu是不活泼金属,只能与浓硫酸反应,与稀硫酸不反应,在过量Cu与一定量浓硫酸反应时,随着反应的进行,硫酸的浓度逐渐减小,反应进行到一定程度时,浓硫酸将变为稀硫酸,反应停止,H2SO4不可能全部参加反应。(2)如果用过量的锌代替铜与一定量的浓硫酸反应,生成气体的成分有哪些?提示:锌首先与浓硫酸发生反应:Zn+2H2SO4(浓)====ZnSO4+SO2↑+2H2O,随着反应的进行,硫酸的浓度降低,锌还会与稀硫酸进一步反应,Zn+H2SO4(稀)====ZnSO4+H2↑,故生成的气体为SO2和H2的混合气体。【案例示范】【典例】(2019·大连高一检测)根据如图所示装置,回答下列问题。(1)开始加热后,产生的现象是a处______________;b处______________。 (2)停止反应后,用酒精灯在b处微微加热,产生的现象是_______________________。 (3)写出a处发生反应的化学方程式:_________。 (4)蘸有Na2CO3溶液的棉花的作用是______________________________。 (5)实验中,取一定质量的铜片和一定体积18 mol·L-1的浓硫酸放在试管中共热,直到反应完毕,发现试管中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。①有一定量的余酸但未能使铜片完全溶解,你认为原因是_______________________。 ②下列药品中能用来证明反应结束后的烧瓶中确有余酸的是________(填字母)。 a.铁粉 b.BaCl2溶液c.银粉 d.NaHCO3溶液【解题指南】解答本题需注意以下两点:(1)明确浓硫酸的强氧化性。(2)Cu与浓硫酸反应过程中H2SO4的浓度对反应的影响。【解析】(1)浓硫酸与铜片反应生成SO2气体,SO2能使品红褪色,生成的CuSO4使溶液变蓝色。(2)被SO2漂白的品红纸条加热时会重新变红。(4)SO2有毒,不能直接排放在空气中,用Na2CO3溶液可以吸收多余的SO2。(5)随着反应的进行,H2SO4被不断消耗,且反应生成水,使硫酸的浓度逐渐减小,当变为稀硫酸时,反应将会停止,因为铜与稀硫酸不反应,可向反应结束后的试管中加入铁粉或NaHCO3溶液,若有气泡产生则可证明确有余酸。答案: (1)有气泡产生,溶液变蓝 纸条褪色(2)纸条由无色恢复为红色(3)Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O(4)吸收多余的SO2,以防止污染环境(5)①反应过程中浓硫酸被消耗,逐渐变稀,而铜不和稀硫酸反应 ②a、d【母题追问】(1)金属锌能否用来验证反应结束后的试管中剩余的硫酸?对于用量有没有要求?提示:能;必须加入过量的锌。金属锌能够与稀硫酸反应放出氢气,同时也能与硫酸铜反应,故应该加入过量的锌。(2)第(5)问①中加入硫酸铁能否使铜片完全溶解?提示:能。三价铁离子具有氧化性,铜片能与硫酸铁反应而使铜片溶解。【方法规律】浓硫酸与不活泼金属或非金属反应的有关规律(1)反应要加热,否则不反应。(2)还原产物一般是SO2,一般金属被氧化为高价态的硫酸盐,非金属被氧化为高价态的氧化物或含氧酸。(3)浓硫酸与金属反应时,既表现酸性又表现强氧化性,而与非金属反应时,只表现强氧化性。(4)浓硫酸与不活泼金属反应时,随着反应的进行,硫酸浓度变小,一旦变为稀硫酸,反应就停止。【迁移·应用】1.(2019·株洲高一检测)浓硫酸在下列物质的转化中,既表现出氧化性,又表现出酸性的是 ( )A.Cu CuSO4B.C CO2C.蔗糖 “黑面包”D.Fe2O3 Fe2(SO4)3【解析】选A。浓硫酸在反应中表现出酸性时硫元素的化合价不变,硫元素仍以 形式存在;浓硫酸表现出氧化性时硫元素的化合价降低。由以上反应可知,C+2H2SO4(浓) CO2↑+2SO2↑+2H2O中硫元素的化合价降低;Fe2O3+3H2SO4====Fe2(SO4)3+3H2O中硫元素的化合价不变;蔗糖 “黑面包”时浓硫酸表现脱水性,同时发生反应C+2H2SO4(浓) CO2↑+2SO2↑+2H2O,又表现氧化性;而Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O,有一部分硫元素化合价降低,一部分硫元素化合价不变,所以浓硫酸在A反应中既表现了酸性,又表现了氧化性。2.用如图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应。下列实验不合理的是 世纪金榜导学号( )A.上下移动①中铜丝可控制反应生成SO2的量B.②中选用品红溶液验证SO2的生成C.③中选用NaOH溶液吸收多余的SO2 D.为确认有CuSO4生成,向①中加水,观察颜色【解析】选D。上下移动铜丝可以控制铜与浓硫酸的接触与分离,从而可以控制反应生成SO2的量,A项正确;SO2可使品红溶液褪色,B项正确;SO2有毒,能与NaOH溶液反应,C项正确;铜与浓硫酸反应后①中溶液显蓝色即可证明有CuSO4生成,无需向其中加水,D项错误。【素养提升】某公路上两辆罐车在行驶时不慎追尾,导致其中一辆罐车内装的浓硫酸发生泄漏。现场几名工人在公路上铺洒石灰。一辆汽车正在向泄漏有浓硫酸的沟渠里灌注液态石灰。(1)现场使用液态石灰处理。这是利用硫酸的什么性质?写出反应的化学方程式。(科学探究与创新意识)(2)现场能否使用自来水进行稀释来处理现场?(科学态度与社会责任)(3)生活生产中常用铁制容器储存和运输浓硫酸,是不是常温下铁不能与硫酸反应?请解释原因。(科学探究与创新意识)(4)能否用水清洗储存浓硫酸的铁罐?请解释原因。(科学探究与创新意识)【解析】(1)铺洒石灰利用了硫酸的酸性,石灰和浓硫酸发生复分解反应。(2)直接浇水稀释浓硫酸会放出大量热,且稀硫酸会对周边环境造成更大的污染,对周围植物也有害。(3)常温下铁与浓硫酸反应钝化,表面形成致密的氧化膜,隔绝铁与浓硫酸的接触而停止反应。(4)用水清洗储存浓硫酸的铁罐时,浓硫酸稀释放热,温度升高,铁与硫酸反应,造成铁罐腐蚀。答案:(1)铺洒石灰利用了硫酸的酸性,石灰和浓硫酸发生复分解反应,化学方程式为CaO+H2SO4====CaSO4+H2O。(2)不能;直接浇水稀释浓硫酸会放出大量热,且稀硫酸会对周边环境造成更大的污染,对周围植物也有害。(3)铁制容器储存和运输浓硫酸,不是常温下铁不能与浓硫酸反应,而是发生反应在铁的表面形成致密的氧化膜,隔绝铁与硫酸的接触而停止反应。(4)不能;用水清洗储存浓硫酸的铁罐时,浓硫酸稀释放热,温度升高,铁与硫酸反应,造成铁罐腐蚀。知识点二 的检验及粗盐的提纯【重点释疑】1. 的检验(1)检验方法:(2)原理:①先加稀盐酸的目的:防止 、 、Ag+的干扰。②过程中可能发生反应的离子方程式: +2H+====H2O+CO2↑、 +2H+====H2O+SO2↑、Ag++Cl-====AgCl↓、 +Ba2+====BaSO4↓。2.粗盐的提纯(1)除去粗盐中不溶性杂质——过滤(2)除去粗盐中可溶性杂质①原理:②加试剂的先后顺序原则:Na2CO3溶液加入顺序在BaCl2溶液之后;加入盐酸在过滤之后。通常顺序可以为BaCl2溶液 NaOH溶液 Na2CO3溶液 盐酸;NaOH溶液 BaCl2溶液 Na2CO3溶液 盐酸;BaCl2溶液 Na2CO3溶液 NaOH溶液 盐酸。【思考·讨论】(1)向某溶液中只加可溶性钡盐,不酸化,产生白色沉淀能否说明溶液中含有 ?提示:不能。若溶液中含有 、 会与钡盐反应产生BaCO3、BaSO3白色沉淀。 (2)若向待测液中滴加BaCl2溶液,有白色沉淀生成,再加稀盐酸白色沉淀不溶解,能否说明溶液中含有 ?提示:不能。若溶液中含有Ag+,也会产生同样的现象: Ag++Cl-====AgCl↓(白色)。(3)向待测液中滴加用稀盐酸酸化的Ba(NO3)2溶液生成白色沉淀,能否说明溶液中含有 ?(已知:酸性环境中 具有强氧化性)提示:不能。在酸性环境中 具有强氧化性,可将 氧化为 。【案例示范】【典例1】同学们都喜欢照相,在照相机底片的处理过程中,照相显影剂(或称显影剂)是一种让感光产生的隐藏影像或印记在底片上显现的化学用剂。亚硫酸钠是照相显影剂中的一种成分。某亚硫酸钠试剂已部分被氧化,为确定它的纯度,要进行如下实验:①取样品W1 g;②将样品溶解;③给溶液加入稍过量的盐酸酸化的BaCl2溶液;④过滤、洗涤、干燥沉淀,称其质量为W2 g。试回答:(1)BaCl2要用盐酸酸化的原因是什么? (科学探究与创新意识)(2)BaCl2溶液要稍过量的原因是什么?(科学探究与创新意识)(3)判断操作③是否完成的方法是什么?(科学探究与创新意识)(4)判断沉淀是否洗净的方法是什么?(科学探究与创新意识)(5)列式计算Na2SO3的纯度。(证据推理与模型认知)【解析】(1)BaCl2与Na2SO3反应也会生成BaSO3白色沉淀,干扰实验。(2)加入稍过量的BaCl2目的是使 完全沉淀。(3)操作③是为了使 沉淀完全,只要检验溶液中有无 即可。(4)沉淀可以吸附溶液中的Cl-,若沉淀洗涤干净,则检验不出Cl-。(5)最后沉淀为BaSO4,由硫元素守恒可知n(Na2SO4)=n(BaSO4)= m(Na2SO3)=W1 g-m(Na2SO4)=W1 g- ×142,则Na2SO3纯度为(1- )×100%。答案:(1)防止BaSO3沉淀的产生而引起误差。(2)使试样中的 完全转化为BaSO4沉淀。(3)将混合液静置,取上层清液少许,继续滴加盐酸酸化的BaCl2溶液,若无白色沉淀生成,则操作③完成。(4)取最后一次洗涤液少许,滴加AgNO3溶液,若无沉淀出现,则已洗净,反之则未洗净。(5)n(Na2SO4)=n(BaSO4)= m(Na2SO3) =W1 g-m(Na2SO4)=W1g- ×142,则Na2SO3纯度为(1- )×100%。【典例2】我国有三大盐场,分别是长芦盐场、布袋盐场和莺歌海盐场。盐场制得的粗食盐中除含有钙离子、镁离子、硫酸根离子等可溶性杂质外,还含有泥沙等不溶性杂质。我们食用的精盐是用粗食盐提纯而得到的。通过教材中“粗盐的提纯”及你做过的该实验完成下列问题:(1)实验室进行NaCl溶液蒸发时,一般有以下操作过程:①固定铁圈位置 ②加热搅拌 ③放置酒精灯 ④停止加热 ⑤放上蒸发皿(蒸发皿中盛有NaCl溶液)。写出正确的操作顺序。(科学探究与创新意识—水平1)(2)如何运用最简单的方法检验溶液中有无 ?如果有,应该如何除去 ?(科学探究与创新意识—水平2)(3)在粗盐经过溶解→过滤后的溶液中滴加饱和Na2CO3溶液,直至不再产生沉淀为止。请问这步操作的目的是什么?(科学探究与创新意识—水平3)(4)将经过操作(3)后的溶液过滤。请问这一操作哪些杂质离子不能除净?(已知MgCO3的溶解度比Mg(OH)2大)(科学探究与创新意识—水平4)【解析】(1)实验室在组装仪器时所遵循的原则是自下而上,从左到右,故操作顺序为③①⑤②④。(2)由于 可与Ba2+生成BaSO4白色沉淀,故可向溶液中加入可溶性钡盐,但要遵循不带入新杂质的原则。(3)为了使杂质离子除净,所用试剂均应稍过量,因此(2)中除 时所加入的可溶性钡盐应过量。加Na2CO3的目的是除去Ca2+和少量Mg2+及过量的Ba2+。(4)由于MgCO3的溶解度比Mg(OH)2大,除Mg2+一般用NaOH溶液,所以此时Mg2+不能除净。答案:(1)③①⑤②④(2)加BaCl2溶液,有白色沉淀产生,则有 ;加过量BaCl2溶液,过滤(3)除去Ca2+、少量的Mg2+及过量的Ba2+(4)Mg2+不能除净【迁移·应用】1.(2019·汕头高一检测)向某溶液中滴入BaCl2溶液,产生白色沉淀,再滴入稀盐酸,沉淀不溶解,则该溶液中 ( )A.一定有 B.可能有 或Ag+C.一定无Ag+ D.可能有 【解析】选B。溶液中加入BaCl2,可产生白色沉淀,再加稀盐酸,两者均不溶解,可能为BaSO4、AgCl等,所以B正确。2.(2019·聊城高一检测)下列关于粗盐提纯的说法中正确的是 ( )A.溶解粗盐时,应尽量让溶液稀一些,防止食盐不完全溶解B.滤去不溶性杂质后,将滤液移至坩埚内加热浓缩C.当蒸发到剩余少量液体时停止加热,利用余热将液体蒸干D.将制得的晶体转移到新制过滤器中,用大量水洗涤【解析】选C。A项中,溶解粗盐时,在保证粗盐溶解的前提下应尽量少加水,避免蒸发时困难;B项中,该操作应在蒸发皿中进行;D项中,用大量水洗涤会造成食盐损失过多。【补偿训练】 (2019·常州高一检测)在实验室中有下列四组试剂,某同学欲分离含有氯化钾、氯化铁和硫酸钡的混合物,应选用的试剂组合是 ( )A.水、硝酸银溶液、稀硝酸B.水、氢氧化钾溶液、硫酸C.水、氢氧化钠溶液、盐酸D.水、氢氧化钾溶液、盐酸【解析】选D。由于混合物中硫酸钡不溶于水,第一步可用水溶解然后过滤的方法分离出硫酸钡。第二步用硝酸银是无法分离氯化钾和氯化铁的,用氢氧化钾可将铁离子转化为氢氧化铁沉淀,并可防止氯化钾溶液中引入其他杂质阳离子,然后通过过滤分离出氢氧化铁。要将氢氧化铁再转化为氯化铁,只能用盐酸来实现,滤液中的过量氢氧化钾也需要盐酸中和生成氯化钾。最终蒸发(蒸发氯化铁溶液要采取一些措施防止水解)得到相应的固体。【课堂回眸】
相关资料
更多









