






科粤版九年级下册8.1 溶液的酸碱性说课课件ppt
展开第八章 常见的酸、 碱、 盐
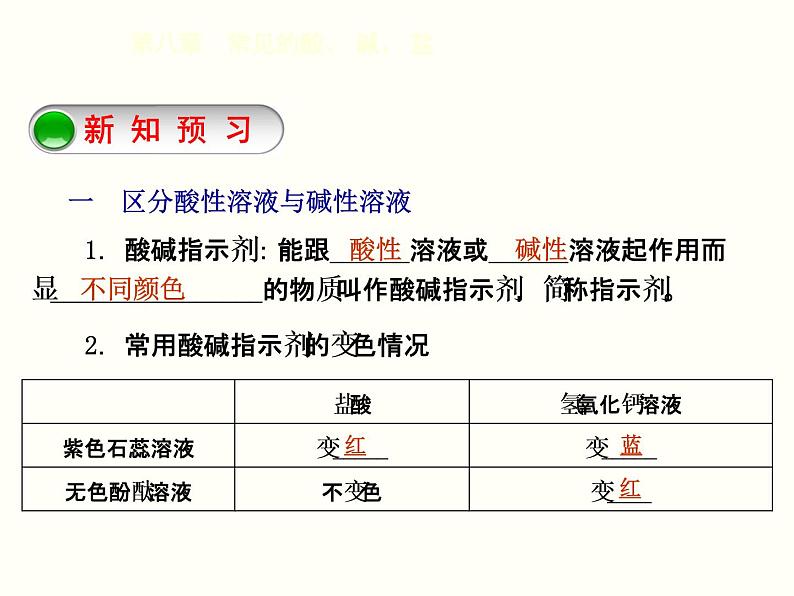
1.酸碱指示剂:能跟______溶液或______溶液起作用而显________________的物质叫作酸碱指示剂,简称指示剂。2.常用酸碱指示剂的变色情况
一 区分酸性溶液与碱性溶液
测定溶液的酸碱性常用___________,而测定溶液的酸碱度常用_________。溶液酸碱性的强弱程度常用______表示。pH与溶液的酸碱性的关系如下:(1)pH____7时,溶液呈______。(2)pH___7时,溶液呈_____;pH越小,溶液的酸性越____。(3)pH____7时,溶液呈____;pH越大,溶液的碱性越____。[说明] (1)溶液的pH一般在________之间;(2)pH=0时溶液呈酸性。
二 pH与溶液的酸碱性
1.测定溶液的pH,最简便的方法是利用___________。2.测定方法:将pH试纸放在白瓷板或玻璃片上,用玻璃棒或胶头滴管取少量待测溶液,滴在_____________上,然后将试纸显示的颜色与_______________比较,便可读出溶液的pH。
溶液的pH对生命活动有重大影响。(1)人体的生理活动要在一定的pH范围内才能正常进行。(2)农作物的正常生长环境也要求一定的pH范围。
四 溶液的pH与生命活动
探究点一 指示剂与溶液的酸碱性
[情景展示] 我们在吃苹果、橘子、葡萄等水果时,都有酸味。
[问题探究] 它们含有酸吗,如何测定呢?
[归纳提升] 可以用酸碱指示剂粗略地测定物质的酸碱性。常见的酸碱指示剂有紫色石蕊溶液和无色酚酞溶液。紫色石蕊溶液遇酸变红,遇碱变蓝;无色酚酞溶液遇酸不变色,遇碱变为红色。
[继续探究] 能使无色酚酞溶液变红的一定是碱溶液吗?不能使无色酚酞溶液变色的一定是酸溶液吗?
[归纳提升] 酸溶液是指溶质是酸的溶液,其一定显酸性,能使紫色石蕊溶液变红,不能使无色酚酞溶液变色;但显酸性的溶液中的溶质不一定都是酸。同样碱溶液一定显碱性,能使紫色石蕊溶液变蓝,使无色酚酞溶液变红;但显碱性的溶液不一定是碱溶液,如碳酸钠溶液。
例1 [2015·上海模拟] 在一无色溶液中滴入数滴酚酞溶液,溶液仍显无色,则可以得出这样的结论:①溶液是中性的;②溶液不可能是碱性的;③溶液可能是酸性的;④如果在该溶液中滴入紫色石蕊溶液,溶液一定仍显紫色。结论中正确的是( )A.①②③④ B.①④C.②③ D.以上答案都不对
[解析] 向某溶液中滴入无色酚酞溶液后仍显无色,则溶液可能呈酸性,也可能呈中性,石蕊在酸性溶液中为红色,在中性溶液中为紫色。
[方法点拨] 酸、碱溶液与酸碱指示剂作用,变色的是指示剂,而酸、碱溶液本身不变色。酸溶液是指溶质是酸的溶液,其一定显酸性,能使紫色石蕊溶液变红,不能使无色酚酞溶液变色;但显酸性的溶液中的溶质不一定都是酸。同样碱溶液一定显碱性,能使紫色石蕊溶液变蓝,使无色酚酞溶液变红;但显碱性的溶液不一定是碱溶液,如碳酸钠溶液。
探究点二 检验溶液酸碱性强弱的程度
[问题探究] 酸碱性的强弱用什么来表示?如何用pH试纸来测定溶液的酸碱度?
[归纳提升] 溶液酸碱性的强弱程度常用pH表示。酸性溶液的pH<7,pH越小,酸性越强,pH=0时,酸性最强;中性溶液的pH=7;碱性溶液的pH>7,pH越大,碱性越强。用pH试纸测定某溶液的pH时,先将pH试纸放在洁净的白瓷板或玻璃片上,用玻璃棒蘸取(或用胶头滴管吸取)少量待测液,滴在pH试纸上,然后与标准比色卡对比颜色,即可读出待测液的pH。
例2 在生活、生产和科学研究中,常用pH试纸测定溶液的pH。以下测定操作正确是( ) A.将被测液滴到放在玻璃片上的pH试纸上,显色后,与标准比色卡比较 B.将pH试纸直接投入被测液中,显色后,取出与标准比色卡比较 C.先用少量水润湿pH试纸,后滴上被测液,显色后,与标准比色卡比较 D.先用蒸馏水清洗滴管,随后吸取被测液滴到pH试纸上,显色后,与标准比色卡比较
[解析] 根据pH试纸的使用方法进行分析。测定溶液pH的具体操作方法为:用干净的玻璃棒蘸取待测溶液并滴在pH试纸上,把试纸显示的颜色与标准比色卡对照,读出相同颜色的pH。
[方法点拨] 测定溶液pH的正确操作方法为:将被测液滴到放在玻璃片上的pH试纸上,显色后,与标准比色卡比较。若将pH试纸直接投入被测液中,会污染被测试剂;若先用少量水润湿pH试纸,相当于用蒸馏水将被测溶液稀释,使测得的pH产生较大误差;若先用蒸馏水清洗滴管,再用滴管吸取被测液滴到pH试纸上,也相当于用蒸馏水将被测溶液稀释,使测得的pH产生较大误差。
知识点1 指示剂的变色 pH与溶液酸碱性的关系
1.无色溶液中滴加1~2滴酚酞溶液,该溶液使无色酚酞溶液变红,这说明该无色溶液是( ) A.酸性溶液 B.碱性溶液 C.酸的水溶液 D.碱的水溶液
[解析] 无色酚酞遇碱性溶液变红,说明该溶液呈碱性,碱的水溶液一定呈碱性,但呈碱性的不一定是碱的溶液,某些盐的溶液也呈碱性,如碳酸钠溶液,属于盐溶液,但呈碱性。
2.小明在家里测定了以下物质的pH,数据一定有误的是( )A.雨水pH=5 B.奥妙洗衣粉pH=12 C.肥皂水pH=4 D.柠檬汁pH=2
[解析] 根据已有的知识进行分析解答。酸性物质的溶液pH小于7,碱性物质的溶液pH大于7,中性溶液的pH等于7。雨水呈酸性,pH可能为5;洗衣粉呈碱性,pH可能为12;肥皂水呈碱性,pH不可能小于7;柠檬汁呈酸性,pH可能为2。故选C。
知识点2 pH的测定方法
4.用pH试纸测定溶液的pH,下列描述正确的是( )A.pH试纸直接浸入待测液B.pH试纸先用水润湿再浸入待测液C.测出溶液的pH为3.5D.用玻璃棒蘸取待测液涂于pH试纸上,观察
知识点3 pH在生产与生活中的应用
5.“浸土选种”是现代农业生产常用的科学方法,取武当山特区某村土壤浸出的溶液,加入无色酚酞溶液后显红色。下表为四种农作物适宜生长的pH范围,你认为该村土壤比较适宜种植的农作物是( )A.玉米 B.茶树 C.水稻 D.马铃薯
科粤版九年级下册第八章 常见的酸、碱、盐8.1 溶液的酸碱性教学演示ppt课件: 这是一份科粤版九年级下册第八章 常见的酸、碱、盐8.1 溶液的酸碱性教学演示ppt课件,共17页。PPT课件主要包含了酸桔子,生活中,“尝起来酸酸的”,“摸起来滑滑的”,谁的酸性强,课堂练习等内容,欢迎下载使用。
初中化学科粤版九年级下册8.1 溶液的酸碱性授课ppt课件: 这是一份初中化学科粤版九年级下册8.1 溶液的酸碱性授课ppt课件,共20页。PPT课件主要包含了学习目标,想一想,活动探究一,不变色,活动探究二,答中性紫色,你知道吗等内容,欢迎下载使用。
科粤版九年级下册8.1 溶液的酸碱性一等奖ppt课件: 这是一份科粤版九年级下册8.1 溶液的酸碱性一等奖ppt课件,文件包含81溶液的酸碱性课件pptx、81溶液的酸碱性doc、ph试纸mp4、酸碱指示剂mp4等4份课件配套教学资源,其中PPT共26页, 欢迎下载使用。













