








- 2.2氯及其化合物(第一课时)课件+教案+练习 课件 87 次下载
- 2.2氯及其化合物(第二课时)课件+教案+练习 课件 87 次下载
- 2.3物质的量(第一课时)课件+教案+练习 课件 84 次下载
- 2.3物质的量(第二课时)课件+教案+练习 课件 86 次下载
- 2.3物质的量(第三课时)课件+教案+练习 课件 82 次下载
高中化学人教版 (2019)必修 第一册第二节 氯及其化合物优秀课件ppt
展开一、新课导入二、氯气的制取三、氯离子的检验四、卤素
氯的单质Cl2是一种重要的化工原料,大量用于制造盐酸、有机溶剂、农药、染料、药品等。
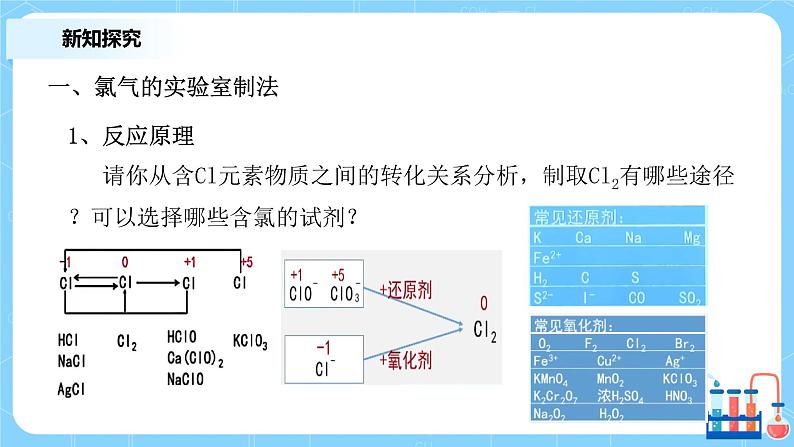
1、反应原理 请你从含Cl元素物质之间的转化关系分析,制取Cl2有哪些途径?可以选择哪些含氯的试剂?
1、反应原理 舍勒发现氯气的方法至今还是实验室中制取氯气的主要方法之一。反应化学方程式:
请分析反应中MnO2和浓HCl的性质? 离子方程式:
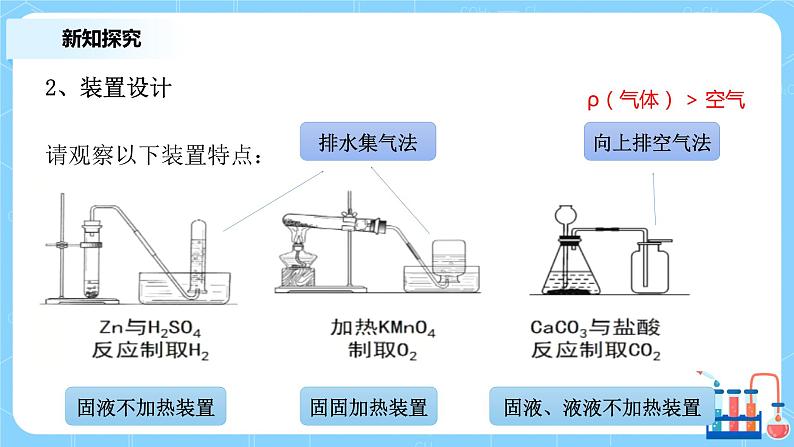
2、装置设计 请观察以下装置特点:
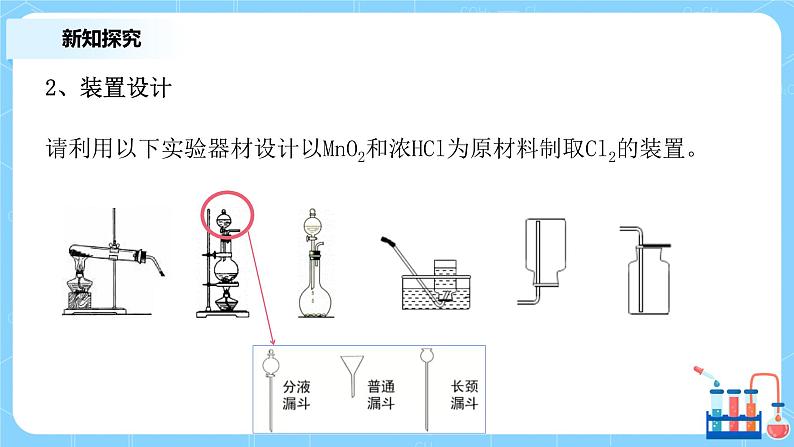
2、装置设计 请利用以下实验器材设计以MnO2和浓HCl为原材料制取Cl2的装置。
MnO2(s)浓盐酸(aq)反应条件:加热
产物:Cl2ρ(Cl2) >ρ(空气)溶于水,与水反应
2、装置设计 刚刚实验视频中制取的Cl2,可能含有哪些杂质?应该如何去除?需要增加哪些装置?
浓HCl易挥发,且为加热装置,所以Cl2 中杂质可能有HCl(g)、H2O(g)。 已知常温常压下:Cl2在H2O中的溶解度约为1:2(1L水溶解2LCl2)。Cl2在饱和食盐水中的溶解度约为1:1(1LNaCl饱和溶液溶解1LCl2)。所以用饱和食盐水吸收HCl,能降低溶于水中的Cl2含量。 Cl2能与碱反应,所以水蒸汽可以用浓硫酸去除。
为什么除H2O(g)放在最后? 饱和食盐水试剂中同样含有水,所以除水放在最后。
1、通Cl2的实验室制取,应注意的事项:
① 滴加浓盐酸时不宜过快,加热不宜过猛,温度不宜过高,因浓盐酸 易挥发,容易造成氯气纯度低。② 实验结束后,先使反应停止并排尽装置中残留的Cl2,再拆卸装置, 避免污染空气。③ 吸收尾气时,不能用澄清石灰水吸收,因溶液中Ca(OH)2浓度小,吸 收不完全。④ MnO2与浓HCl反应,保证浓HCl过量,当变成稀HCl,反应停止。
要根据气体制取原理、实际需要设计实验装置。具体如下:① 依据反应物的状态和反应条件 → 选择气体发生装置 ② 依据气体及其所含的杂质的性质 → 选择除杂装置(考虑除杂顺序)③ 依据气体的密度、气体在水中的溶解性,以及是否与水反应 → 选择收集装置④ 依据气体性质 → 选择尾气处理装置装置的连接顺序一般为:气体发生装置→除杂装置→收集装置→尾气处理装置。
2、通过Cl2的实验室制取,请总结出实验室制取气体的装置,应该 考虑哪些方面?
3、实验室用MnO2和浓HCl制取Cl2时,如果缺少MnO2,可以用什么 代替?如果缺少浓HCl,可以用什么代替?
在舍勒的基础上,法国化学家贝托莱,将软锰矿、浓硫酸、NaCl固体混合加热,制得了Cl2
(1)在三支试管中分别加入2-3mL稀盐酸、NaCl溶液、Na2CO3溶液, 然后各滴入几滴AgNO3溶液,观察现象。 (2)再分别加入少量稀HNO3,观察现象。
在用AgNO3溶液检验Cl-时,一般先在被检测的溶液中滴入适量稀硝酸,使其酸化,以排除CO32−等的干扰,然后滴入AgNO3溶液,如产生白色沉淀,则可判断该溶液中含有Cl-。
一、氯气的实验室制取二、氯离子的检验
请思考氯气的工业制法。
人教版 (2019)必修 第一册第二节 氯及其化合物精品课件ppt: 这是一份人教版 (2019)必修 第一册第二节 氯及其化合物精品课件ppt,共52页。PPT课件主要包含了化学与生活,氯气的制备,氯气制备原理,学习目标,你还记得我吗,H2CO2,问题探究,Cl-,Cl2,ClO-等内容,欢迎下载使用。
人教版 (2019)必修 第一册第二节 氯及其化合物试讲课ppt课件: 这是一份人教版 (2019)必修 第一册第二节 氯及其化合物试讲课ppt课件,共60页。PPT课件主要包含了氯气的性质,氯气长什么样子,HClO,次氯酸的不稳定性,还有什么疑问,课堂小结,Cl2等内容,欢迎下载使用。
高中化学人教版 (2019)必修 第一册第二章 海水中的重要元素——钠和氯第二节 氯及其化合物备课ppt课件: 这是一份高中化学人教版 (2019)必修 第一册第二章 海水中的重要元素——钠和氯第二节 氯及其化合物备课ppt课件,共26页。PPT课件主要包含了氯气的化学性质,氯气的物理性质,本课目录,新制氯水与久置氯水,化学史,黄绿色,有刺激性气味,能溶于水,易液化,大于空气等内容,欢迎下载使用。














