









人教版 (2019)必修 第二册第一节 硫及其化合物授课ppt课件
展开在新闻报道中,我们经常听到有关酸雨的报道。酸雨对我们的环境和生活产生了巨大的影响,今天我们学习一种会导致酸雨污染的物质---硫
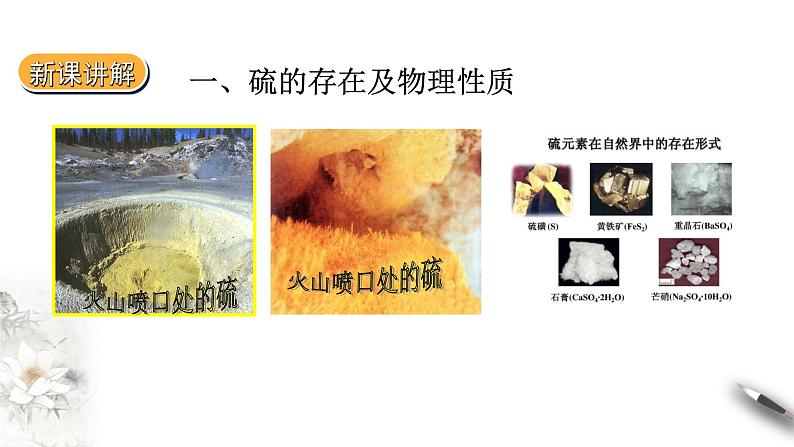
一、硫的存在及物理性质
(1)铜 2Cu+S===Cu2S (黑色)
(2)铁 Fe+S===FeS (黑色)
(3)汞 Hg+S===HgS(除汞)
硫的氧化性较弱,与Cu、Fe等变价金属反应生成低价的硫化物。
反应现象:(火焰)空气中:淡蓝色, 纯氧中:明亮蓝紫色
3S+6NaOH=== 2Na2S+ Na2SO3+3H2O
S+2H2SO4(浓)=== 3SO2↑+2H2O
(1)S、Cl2与Fe、Cu反应的产物有何差异?原因是什么?
(2)如何洗涤附着在试管内壁上的硫?
原因:(1)硫是一种弱氧化剂,与可变价金属(如Fe、Cu)反应时,生成低价金属硫化物,而Cl2的氧化性强于S,与可变价金属作用,生成高价态氯化物。(2)可用CS2或热NaOH溶液洗涤试管内壁的硫。
三、硫的氧化物---SO2
无色有刺激性气味的有毒气体,密度比空气大,易液化,易溶于水,一体积水溶解40体积SO2(1:40)。
SO2是一种酸性氧化物SO2中硫元素为+4价,属于中间价态,SO2既有还原性又有氧化性.
如图5-2所示,把充满SO2、塞有橡胶塞的试管倒立在水中,在水面下打开橡胶塞,观察试管内页面的上升。待液面高度不再明显变化时,在水下用橡胶塞塞紧试管口,取出试管,用pH试纸测定溶液的酸碱度(保留该溶液供实验5-2使用)。
实验现象:SO2溶于水,生成亚硫酸,溶液显酸性 反应的方程式为:SO2+H2O⇌H2SO3⇌H++HSO3- 注意:形成的亚硫酸在空气中长时间放置会发生反应: 2H2SO3+O2=2H2SO4
在同一条件下,既能向正反应方向进行,同时又能向逆反应的方向进行的反应,叫做可逆反应 。向生成物方向进行的叫做正反应,向反应物方向进行的叫做逆反应。
c.与碱反应:与NaOH溶液反应:SO2+2NaOH===Na2SO3+H2O
a.与H2O反应:SO2+H2O⇌H2SO3
b.与碱性氧化物反应与CaO反应:CaO+SO2===CaSO3。
②还原性:SO2能被O2、X2(Cl2、Br2、I2)、KMnO4(H+)溶液等强氧化剂氧化。
b.与X2反应:X2+SO2+2H2O===2HX+H2SO4
③氧化性:与H2S反应:SO2+2H2S===3S↓+2H2O
c. 5SO2+2MnO4-+2H2O=2Mn2++5SO42-+4H+
a.与O2反应:2SO2+O2 2SO3,该反应为可逆反应。
用试管取2mL在实验5-1中得到的溶液,向其中滴入1~2滴品红溶液,振荡,观察溶液的颜色变化。然后加热试管,注意通风,再观察溶液的变化。(如图5-3)
实验现象:加入品红后,红色逐渐消失;加热后,又恢复红色结论:二氧化硫具有漂白性,会生成不稳定的化合物,加热化合物分解,又会恢复红色。注意:SO2遇到紫色石蕊试液,紫色石蕊试液变红不褪色。
SO2可与某些有色物质生成不稳定的无色物质,但见光、加热或长时间放置,不稳定物质又分解为原有色物质和SO2。SO2+H2O+有色物质——→化合不稳定无色物质——→△有色物质。
将有色物质氧化成无色物质
较大表面积,吸附有色物质
HClO、Ca(ClO)2Na2O2、H2O2
1)原理: Na2SO3+H2SO4(浓) = Na2SO4 + H2O +SO2↑
2)原料: 亚硫酸钠粉末和浓硫酸
4)除杂装置:浓硫酸
5)收集装置:向上排空气法
6)尾气处理装置:用氢氧化钠溶液吸收SO2
① SO2有刺激性气味,有毒,排入空气中会污染空气
② SO2和NO2是形成酸雨的主要物质
③ 酸雨的PH值小于5.6
正常雨水的PH=5.6,是因为溶有CO2
④酸雨的防治:开发新能源,安装工业脱硫装置,尾气处理。
(2)化学性质——酸性氧化物的通性: ①与H2O反应:SO3+H2O===H2SO4 ②与CaO反应:SO3+CaO===CaSO4 ③与Ca(OH)2溶液反应:SO3+Ca(OH)2===CaSO4↓+H2O
(1)物理性质:SO3的熔点16.8 ℃,沸点44.8 ℃,在标准状态下SO3为固态。
四、硫的氧化物---SO3
①硫化氢是一种无色、有臭鸡蛋气味的气体,剧毒。
②水溶液的弱酸性(氢硫酸) H2S⇌H++HS- , HS- ⇌H++S2-
③还原性:H2S能被SO2、O2、Cl2、Fe3+等氧化 2FeCl3+H2S==2FeCl2+S↓+2HCl,SO2+2H2S=3S↓+2H2O
④可燃性:O2+2H2S====2S+2H2O
3O2+2H2S====2SO2+2H2O
氧化产物一般是S,相邻价态变化!
1.硫及其氧化物的性质
S+2H2SO4(浓)
【分析】①Cu和S反应生成Cu2S;②FeS可以由两者反应生成;③S和O2反应生成SO2;④H2S可以由两者反应生成;⑤Fe和Cl2反应生成FeCl3。故答案为:A
1.下列物质中,不能由单质直接化合生成 ( )①CuS ②FeS ③SO3 ④H2S ⑤FeCl2A.①③⑤ B.①②③⑤C.①②④⑤ D.全部
2.将SO2分别通入下表所列的溶液中,填写有关问题。
3.下列实验中能证明某气体一定为SO2的是( )①使澄清石灰水变浑浊 ;②使湿润的蓝色石蕊试纸变红;③使品红溶液褪色;④通入足量NaOH溶液中,再滴加BaCl2溶液,有白色沉淀生成,该沉淀溶于稀盐酸;⑤通入溴水中,能使溴水褪色,再滴加Ba(NO3)2溶液有白色沉淀产生。A.都能证明 B.都不能证明C.③④⑤均能证明 D.只有⑤能证明
解析:选D。①二氧化碳也能使澄清石灰水变浑浊;②酸性气体都能使湿润的蓝色石蕊试纸变红,如HCl;③有氧化性的气体也可以使品红溶液褪色,如氯气;④二氧化碳通入足量氢氧化钠溶液中能生成碳酸钠,再加入氯化钡溶液也产生溶于稀盐酸的白色沉淀。⑤SO2与溴水反应的化学方程式为:SO2+Br2+2H2O===2HBr+H2SO4,再滴加Ba(NO3)2溶液有白色沉淀产生,可证明有SO42-生成,两种现象结合可以证明气体为SO2。
高中化学人教版 (2019)必修 第二册第一节 硫及其化合物一等奖ppt课件: 这是一份高中化学人教版 (2019)必修 第二册第一节 硫及其化合物一等奖ppt课件,共13页。PPT课件主要包含了第一节硫及其化合物,本节整理提升,硫及其化合物,含硫物质的转化,O2H2,O2H2S,催化剂△等内容,欢迎下载使用。
高中化学人教版 (2019)必修 第二册第一节 硫及其化合物完美版ppt课件: 这是一份高中化学人教版 (2019)必修 第二册第一节 硫及其化合物完美版ppt课件,共60页。PPT课件主要包含了第一节硫及其化合物,尝试解答等内容,欢迎下载使用。
高中化学人教版 (2019)必修 第二册第一节 硫及其化合物评优课课件ppt: 这是一份高中化学人教版 (2019)必修 第二册第一节 硫及其化合物评优课课件ppt,共60页。PPT课件主要包含了第一节硫及其化合物,第2课时硫酸,硫酸的性质,微判断,尝试解答,微训练,研习1硫酸的性质,课时作业二硫酸等内容,欢迎下载使用。













