





初中化学人教版九年级下册课题2 溶解度图片ppt课件
展开1.下列因素与固体溶解性无关的是( )A.温度 B.溶剂的种类C.溶质的种类 D.固体颗粒的大小
2.在20 ℃时,将40 g硝酸钾放入100 g水中,充分搅拌后,仍有8.4 g硝酸钾固体未溶解。所得溶液是20 ℃时硝酸钾的_______溶液(选填“饱和”或“不饱和”);所得溶液的溶质和溶液质量比为_______________。
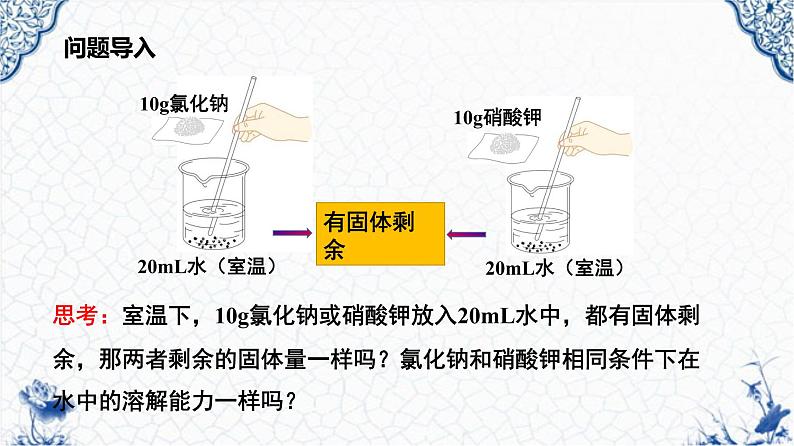
思考:室温下,10g氯化钠或硝酸钾放入20mL水中,都有固体剩余,那两者剩余的固体量一样吗?氯化钠和硝酸钾相同条件下在水中的溶解能力一样吗?
必须限定是相同质量的水。
必须确定在同一温度下。
必须明确都要达到饱和状态。
判断两种固体物质溶解的多少时,需要限定的条件:
固体物质溶解度:在一定温度下,某固态物质在100克溶剂里达到饱和状态时所溶解的质量,叫做这种物质在这种溶剂里的溶解度。
定量地描述不同物质的溶解能力的大小。
知识点1 固体溶解度的定义【课堂活动1】阅读课本第35、36页,找出固体的溶解度概念和概念的“四要素”。回答下列问题:(1)20 ℃时,硝酸钾的溶解度为31.6 g的含义是什么?___________________________________________________。
20 ℃时,100 g水里溶解31.6 g硝酸钾,溶液达到饱和状态
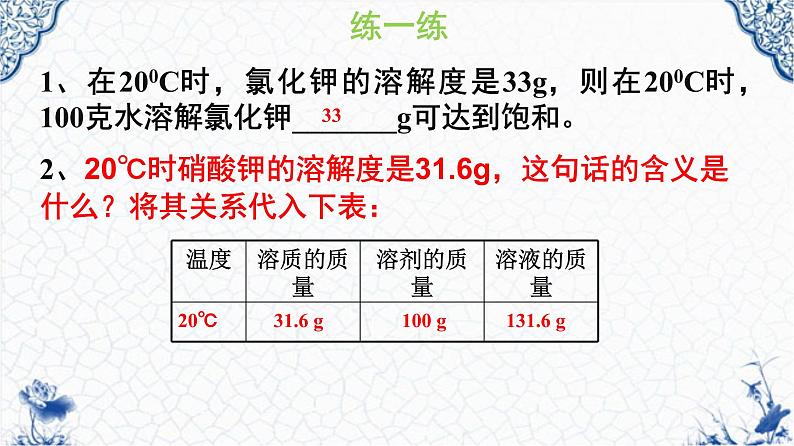
2、20℃时硝酸钾的溶解度是31.6g,这句话的含义是什么?将其关系代入下表:
1、在200C时,氯化钾的溶解度是33g,则在200C时,100克水溶解氯化钾_______g可达到饱和。
练一练
(2)下列说法错在哪里?①20 ℃时,20 g某物质溶解在100 g水里形成溶液,则20 ℃时某物质的溶解度是20 g。(_____________) ②20 ℃时,20 g某物质溶于水制成饱和溶液,则20 ℃时该物质的溶解度是20 g。(_________________)③20 g某物质在100 g水里恰好制成饱和溶液,所以该物质的溶解度为20 g。(_____________)④20 ℃时,100 g水里最多只能溶解20 g某物质,则20 ℃时该物质的溶解度为20。(______________)
[小结]1.固体的溶解度概念:_______________________________________________________________________。注意:根据某温度下的溶解度,要能确定该温度下饱和溶液中:溶质、溶剂、溶液的质量比。
在一定温度下,某固态物质在100 g溶剂里达到饱和状态时所溶解的质量
2.溶解度的概念包括四个要素:_______________________________________。【课堂练习1】20 ℃时,A物质的溶解度为25 g,则该温度下A物质的饱和溶液中溶质和溶液的质量比为_________;溶质和溶剂的质量比为__________。
温度、100g溶剂、饱和状态、单位:g
溶解度的相对大小(20℃)
知识点2 固体溶解度的表示方法和结晶方法的选择1.固体溶解度的表示方法:表格法和溶解度曲线
优势:准确不足:不能表示某种物质任意温度时的溶解度
硝酸钾在不同温度时的溶解度:
【课堂活动2】完成课本第36、37页“探究溶解度曲线”,并在图9-11中绘制有关物质的溶解度曲线。
10 20 30 40 50 60 70 80 90 100
点:曲线上的点均表示某物质在该温度下的溶解度。
交点:曲线的交点表示这两种物质在该温度下的溶解度相同。
200190180170160150140130120110100908070605040302010
大多数物质的溶解度,随温度的升高而增大;曲线越陡,该物质的溶解度受温度影响越大,如硝酸钾;
少数固体物质溶解度受温度影响不大, 例如:食盐。
交流讨论:根据固体物质的溶解度曲线,你能获得哪些信息?
曲线:曲线越陡,该物质的溶解度受温度影响越大。
极少数固体物质的溶解度随温度的升高而减小,如氢氧化钙。
根据溶解度曲线确定从饱和溶液中析出晶体或进行混合物分离提纯的方法。
从溶解度曲线分析结晶情况
1.降温结晶(又叫冷却热饱和溶液法)
适用于溶解度受温度影响较小的物质如:NaCl
适用于溶解度受温度影响较大的物质如:KNO3
选择适宜方法(结晶法)分离混合物。·对溶解度受温度变化影响小的固态溶质,一般用蒸发结晶的方法得到晶体,如氯化钠。·对溶解度受温度变化影响大的固态溶质,一般用冷却热饱和溶液的方法得到晶体,如硝酸钾。
交流讨论:我国有许多盐碱湖,湖水中溶有大量的氯化钠和纯碱(碳酸钠)。那里的人们冬天捞碱,夏天晒盐。这是为什么呢?
氯化钠的溶解度受温度影响小,夏天时,温度高,水分蒸发后,氯化钠以晶体形式析出,得粗盐,这就是夏天晒盐。而碳酸钠的溶解度受温度影响大,夏天温度高,它以溶液的形式存在,冬天时,温度降低,它以晶体形式析出,沉于湖底,可打捞得到,这就是冬天捞碱。
2.固体物质的溶解度与温度的关系和结晶方法的选择(1)多数固体物质的溶解度随温度升高而增大,如___________;结晶方法选择____________。(2)少数固体物质的溶解度受温度变化的影响很小,如_________;结晶方法选择___________。(3)极少数固体物质的溶解度随温度升高而减小,如___________。
【课堂练习2】1.甲、乙、丙三种固体物质的溶解度曲线如右图所示。据图回答问题:(1)80 ℃时,甲、乙、丙三种物质溶解度大小关系为____________。(2)t2 ℃时,甲物质的饱和溶液中,溶质质量和溶液质量的比为_______。
(3)t2 ℃时,把20 g乙物质加到50 g水中,充分搅拌后所得溶液为______(填“饱和”或“不饱和”),溶液的质量是_____g,其中溶质和溶剂的质量比为________。(4)将80 ℃时,等质量的甲、乙、丙饱和溶液降温至t1 ℃,所得溶液质量最大的是____。(5)除去甲中混有少量乙的方法是____________(填“蒸发结晶”或“降温结晶”)。
2.根据下表回答问题。
(1)20 ℃时,三种物质溶解度由大到小的顺序为______________________。
NH4Cl>NaCl>KNO3
(2)20 ℃时,100 g水中加40 g氯化钠充分溶解,得到的是氯化钠的________溶液(填“饱和”或“不饱和”),溶质和溶液的质量比为___________。(3)40 ℃时,氯化铵饱和溶液中溶质和溶剂的质量比为____________。(4)将100 g KNO3放入盛有100 g80 ℃水的烧杯中,然后降温至20 ℃,析出固体的质量为________g。
1.下列加速物质固体溶解的措施中,能改变固体物质的溶解度的是( )A.把固体研细B.搅拌 C.加热D.振荡
2.在20 ℃时,测得50 g水中溶解18 g氯化钠恰好形成饱和溶液,由此可知( )A.氯化钠的溶解度为18 gB.氯化钠的溶解度为36 gC.20 ℃时氯化钠的溶解度为18 gD.20℃时氯化钠的溶解度为36 g
3.升高温度,下列物质中溶解度降低的是( )A.熟石灰B.硝酸钾C.硝酸钠 D.氯化钠
4.右表是高氯酸钾在不同温度时的溶解度。下列说法正确的是( )
A.20 ℃时高氯酸钾的溶解度为1.68B.高氯酸钾的溶解度随温度升高而减小C.80 ℃的高氯酸钾饱和溶液冷却至40 ℃有结晶现象D.40 ℃时,高氯酸钾晶体溶于100 g水中可得到104 g溶液
5.甲、乙两种物质的溶解度曲线如右图所示,下列说法正确的是( )A.甲的溶解度比乙的大B.t1 ℃时,将50 g水与20 g甲混合,可以得到70 g溶液C.除去甲中混有少量的乙,用蒸发结晶的方法D.t1 ℃时,等质量的甲、乙固体配成饱和溶液,得到甲溶液的质量大
可比较同一温度下,不同溶质的溶解度大小;
方法:做垂直于这个温度的直线,由上而下进行比较。如图:硝酸钠>氯化铵>氯化钠>硼酸
B点表示的是什么含义?所对应的溶液是饱和溶液还是不饱和溶液?
曲线上的点表示物质对应温度下的溶解度。对应溶液为该温度下的饱和溶液
A点表示的是什么含义?所对应的溶液是饱和溶液还是不饱和溶液?
.曲线下面所表示的溶液为不饱和溶液
曲线上的交点表示什么含义?
表示两物质溶解度在该温度下正好相等
1.溶解度曲线图中“点”的含义(如右图所示)(1)曲线下方的“点”,如点b属于该温度下对应物质的不饱和溶液。(2)曲线上的“点”,如点a属于该温度下对应物质的饱和溶液。
(3)改变温度时曲线图中“点”的变化,先将横坐标(温度)平移,然后观察“点”处于对应物质曲线的位置,若在曲线上和曲线下方,则纵坐标不改变,若在曲线上方,则有晶体析出。
①曲线下方的区域表示该物质的不饱和溶液。
(3)曲线上方的“点”,如点c为饱和加结晶,曲线上方的一段为结晶,就是曲线上方一段会以晶体形式析出,然后降到曲线。曲线上方的点不是真实存在的。2.降温结晶包含的系列操作:配制成热的浓溶液(或蒸发浓缩)、降温结晶、过滤等。
3.易错点(1)曲线上的交点:表明该温度下,有关物质的溶解度相等;饱和溶液的浓度相同,关键词“饱和”。(2)降温结晶判断饱和溶液析出晶体质量的大小,要注意关键词“等质量”,否则不能判断;等质量的某温度下的饱和溶液降温,所得溶液的质量比较,析出晶体质量越大,所得溶液质量越小。
1、交点含义: 对应温度下,物质的溶解度相等
2、比较溶解度大小: 注意指明温度才能比较大小
3、饱和溶液升温或降温析出晶体多少比较: 注意指明等质量的饱和溶液
初中化学人教版九年级下册第九单元 溶液课题2 溶解度示范课课件ppt: 这是一份初中化学人教版九年级下册第九单元 溶液课题2 溶解度示范课课件ppt,共24页。PPT课件主要包含了一饱和溶液,实验探究,想一想,溶液是否饱和的判断,概念上,外观上,饱和溶液,不饱和溶液,蒸发结晶,二溶解度等内容,欢迎下载使用。
初中化学人教版九年级下册课题2 溶解度集体备课课件ppt: 这是一份初中化学人教版九年级下册课题2 溶解度集体备课课件ppt,文件包含课题2溶解度第2课时pptx、课题2溶解度第1课时pptx、课题2溶解度第3课时pptx、饱和溶液和不饱和溶液转化mp4、蒸发结晶mp4、美丽的结晶mp4、美丽的化学mp4、硝酸钾结晶配乐版wmv、硝酸钾溶于水mp4、氯化钠溶解水中mp4、硝酸钾和氯化钠的分离mp4、气体物质的溶解度定义mp4、气体物质的溶解度与温度关系mp4、气体物质的溶解度与压强关系mp4、怎样比较固体物质溶解能力的大小剪后mp4、实验9-6硝酸钾的溶解mp4、实验9-5氯化钠的溶解mp4、饱和溶液和不饱和溶液指名溶质mp4等18份课件配套教学资源,其中PPT共64页, 欢迎下载使用。
初中化学人教版九年级下册课题2 溶解度背景图ppt课件: 这是一份初中化学人教版九年级下册课题2 溶解度背景图ppt课件,文件包含课题2溶解度pptx、氯化钠在水中的溶解mp4、海水晒盐mp4、硝酸钾在水中的溶解mp4等4份课件配套教学资源,其中PPT共59页, 欢迎下载使用。













