


初中人教版课题2 溶解度获奖课件ppt
展开氢气:难溶于水氮气:难溶于水一氧化碳:难溶于水
思考:我们学过那些气体,它们的溶解性如何?
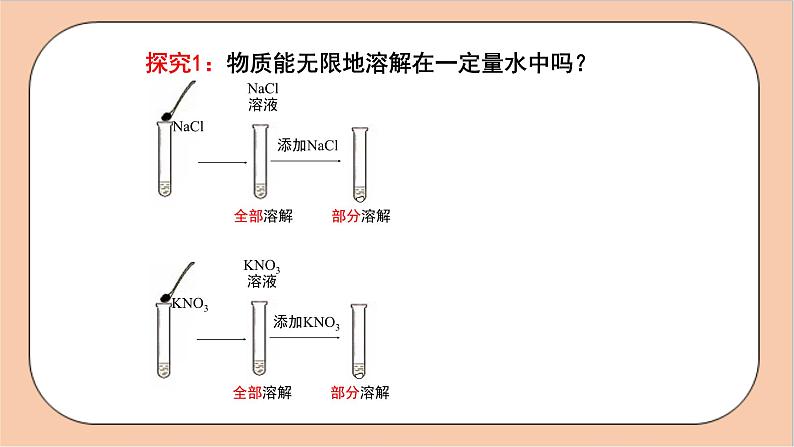
蔗糖、食盐等物质在一定量的水中能够无限制地溶解吗?
探究1:物质能无限地溶解在一定量水中吗?
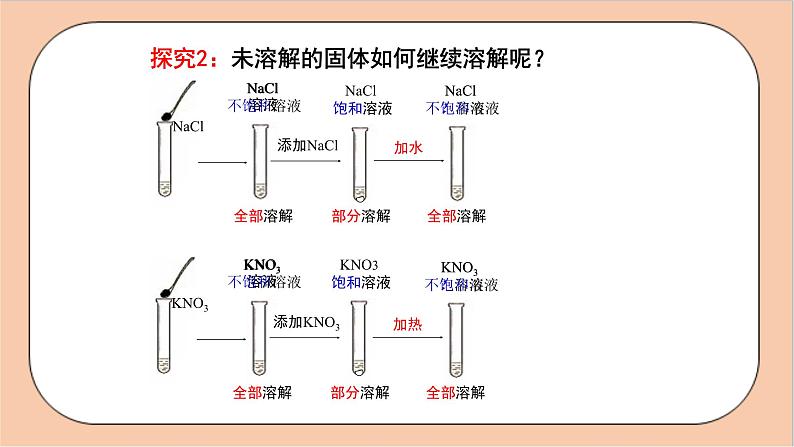
探究2:未溶解的固体如何继续溶解呢?
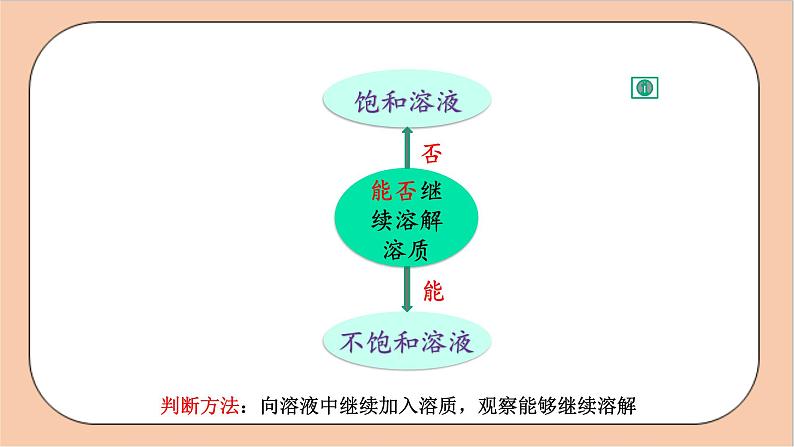
判断方法:向溶液中继续加入溶质,观察能够继续溶解
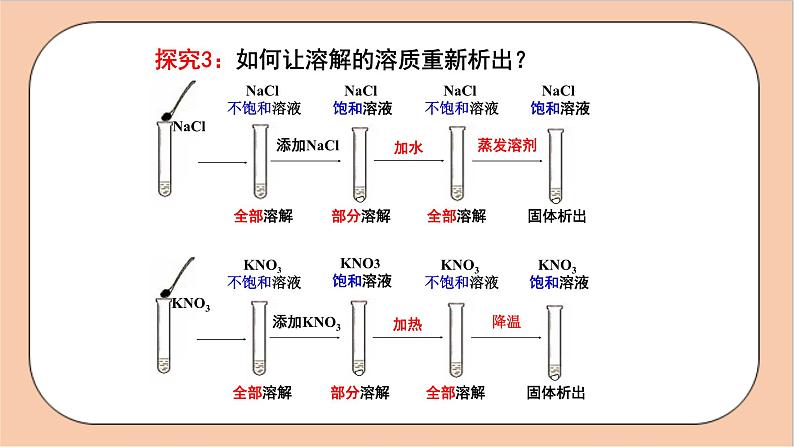
探究3:如何让溶解的溶质重新析出?
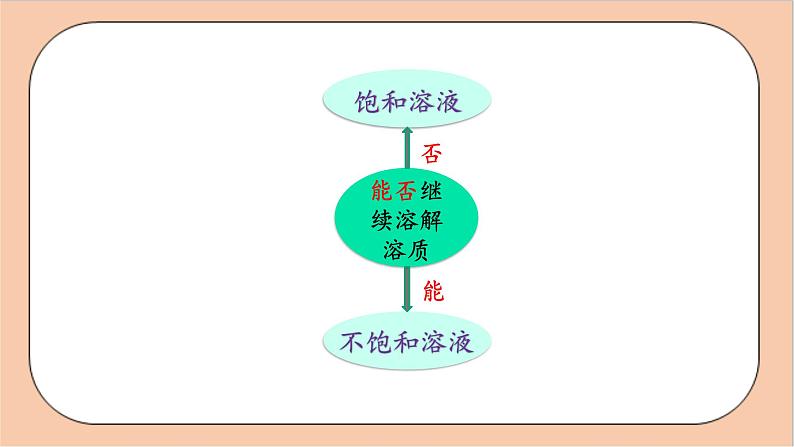
能否继续溶解 溶质
探究4:饱和溶液是否不能再继续溶解任何溶质?
一、饱和溶液、不饱和溶液
2 .判断溶液是否饱和:
向溶液中加入该溶液的溶质,若不能继续溶解,则溶液为饱和溶液。
1 .饱和溶液的概念:
在一定温度下,一定量溶剂中,不能再溶解某种溶质的溶液,叫做这种溶质的饱和溶液。
3 .饱和溶液与不饱和溶液的转化
蒸发溶剂、降低温度、加入溶质
1、将KNO3饱和溶液(底部无固体)转变为KNO3不饱和溶液,下列量如何改变?
2.将KNO3不饱和溶液转变为KNO3饱和溶液(底部无固体),下列量如何改变?
3. 饱和溶液与不饱和溶液的转化
(从溶液中析出固体的过程)
(1)降温结晶(冷却热饱和溶液)
应用一:海水中提取粗盐
感悟价值:生产生活中的结晶的应用
总结分析:物质溶解的限度
a.在一定温度下b.在100g溶剂里c.达到饱和状态d.指溶解的溶质质量(单位:g)
——物质溶解性的定量表示
在20℃时,氯化钠在100g水中达到饱和状态时溶解的质量为36g。
“氯化钠在20℃时的溶解度是36g。”这句话的含义是什么?
在20℃时,100g水中最多可溶解36g氯化钠。
20℃几种固体物质在水中的溶解度
(1)100g水中最多能溶解NaCl40g,则NaCl的溶解度为40g。
(2)一定温度下,100gKNO3的饱和溶液中含KNO330g,则KNO3在该温度时的溶解度为30g。
(3)4℃时,120g CuSO4饱和溶液中含溶质20g,所以4℃时CuSO4的溶解度为20。
(4)20℃时,50g水中溶有NaNO320g,则NaNO3在20℃时的溶解度为40g。
学以致用:判断下列说法是否正确
该气体的压强为101kPa和一定温度时,在1体积水里溶解达到饱和状态时的气体体积。
0℃时,氧气的溶解度为0.049的含义是什么?
在0℃,氧气压强为101kPa时,1体积水最多能溶解0.049体积氧气
影响气体溶解度的因素:
应用二:夏天晒盐冬天捞碱
3.根据常温下物质在水中溶解度的不同,将物质进行分类:
S≥10g:易溶1g≤S<10g:可溶0.01g≤S<1g:微溶S<0.01g:难溶
2.影响物质溶解度的因素:
溶质、溶剂的种类(内因)温度(外因)
*一定温度下,某物质的溶解度不随溶剂质量、溶液质量、饱和与否而改变。
已知20℃时,NaCl的溶解度为36g,则:
(1)20℃时,在50g水中最多能溶解 g NaCl固体。(2)20℃时, g NaCl固体溶解在 g水中能形成272gNaCl饱和溶液。
(3)20℃时,将54g NaCl固体放入150g水中,充分搅拌后,得到的是NaCl的 溶液(饱和/不饱和),其溶液的质量分数为 。(4)20℃时,将40g NaCl固体放入100g水中,充分搅拌后,得到的是NaCl的 溶液(饱和/不饱和),其溶液的质量分数为 。
已知t℃时,A物质的溶解度为Sg,则:
(1)t℃时,A物质的饱和溶液的m(溶质):m(溶剂):m(溶液)=
(2)t℃时,A物质的饱和溶液的溶质质量分数为
4.同一温度下,某物质的饱和溶液的ω是一个定值,不随饱和溶液中溶质或溶剂量的变化而变化。
S : 100 :(100+S)
S/(100+S)×100%
(1)已知20℃时,S(蔗糖)=204g,将200g蔗糖放入100g水中,充分溶解后得到的是蔗糖的 溶液,其ω= 。
(2)已知20℃时,S(氢氧化钙)=0.2g,将1gCa(OH)2放入100g水中,充分溶解后得到的是Ca(OH)2的 溶液,其ω= 。
(3)已知20℃时,S(氢氧化钙)=0.2g,将0.15gCa(OH)2放入100g水中,充分溶解后得到的是Ca(OH)2的 溶液,其ω= 。
(4)已知75℃时,S(氢氧化钙)=0.1g,将0.1gCa(OH)2放入100g水中,充分溶解后得到的是Ca(OH)2的 溶液,其ω= 。
1、浓溶液:ω相对较大的溶液 稀溶液:ω相对较小的溶液
讨论:有人说饱和溶液一定是浓溶液,不饱和溶液一定是稀溶液?你认为呢?
*一定温度下,同种溶质在同种溶剂中的饱和溶液一定比不饱和溶液浓。
讨论:饱和溶液一定比不饱和溶液浓度大?
横坐标:温度(℃) 纵坐标:溶解度(g)
横坐标:温度(℃),纵坐标:S(g)
(1)可以查出同一物质在不同温度时的S
(2)可以比较不同物质在同一温度时的S
(3)可以看出不同物质的S随温度的变化情况
多数固体S随温度上升而增大,如KNO3、NH4Cl
有些固体S随温度变化影响不大,如NaCl
少数固体S随温度上升而减小,如Ca(OH)2
对于Ca(OH)2溶解性随温度升高而降低
加入溶质、蒸发溶剂、升高温度 (恒温)
t1℃时,C物质的溶解度为24g
t2℃时,A、C两种物质的溶解度相同,均为20g
在t2℃时,A、B两种物质的饱和溶液
在t2℃时,A、B两种物质的不饱和溶液
在t1℃时,B物质的不饱和溶液
曲线上的点,表示溶液处于饱和状态
曲线下方的点,表示溶液处于不饱和状态
曲线上方的点,表示溶液处于过饱和状态
60℃ 时硝酸钾饱和溶液
40℃ 时硝酸钾饱和溶液
20℃ 时硝酸钾饱和溶液
60℃ 时硝酸钾不饱和溶液
4.曲线上点的六种移动情况
如上的六种操作中,能从溶液中析出固体的是第⑥种情况。
①平行于横坐标,向左移动 降低温度
②平行于横坐标,向右移动 升高温度
③垂直于横坐标,向上移动 恒温蒸发溶剂或加入溶质
④垂直于横坐标,向下移动 加入溶剂
⑤沿曲线向上移动 升高温度同时加溶质
⑥沿曲线向下移动 降低温度
如何使溶液从P点Q点?
P→N→Q:降温到20℃
P→M→Q:加溶质/蒸发溶剂,降温到20℃
P→Y→Q:加溶剂,降温到20℃
② 在t2℃时,将25gA放入到100g水中,充分溶解后得到的是A物质的 溶液,ω(A)=
20g/120g×100%
① 在t1℃时,将20gC放入到100g水中,充分溶解后得到的是C物质的 溶液,ω(C)=
④在t1℃时,三种物质饱和溶液的溶质质量分数大小关系:
③ t3℃时,C物质的饱和溶液的溶质质量分数是: 在230gB物质的饱和溶液中含有B物质______g
15g/115g×100%
(1)t2℃时,a、b、c三种物质饱和溶液的溶质质量分数大小关系是________________。
(2)t1℃时,a、b、c三种物质饱和溶液的溶质质量分数大小关系是________________。
(3)若将a、b、c三种物质饱和溶液分别从t2℃降温至t1℃后,所得溶液的溶质质量分数大小关系是________________。
(4)若将a、b、c三种物质饱和溶液分别从t1℃升温至t2℃后,所得溶液的溶质质量分数大小关系是________________。
左图为两种固体物质在水中的溶解度曲线,下列说法正确的是( )
A.降低温度能使乙的不饱和溶液变成饱和溶液B.在t1℃时,甲乙的溶液的溶质质量分数相同C.在t2℃时,N点表示乙物质的不饱和溶液D.在t1℃时,50g水可以溶解25g甲物质。E.甲的溶解度大于乙的溶解度F.常温下,甲乙都易溶于水G.t2℃时,等质量的甲和乙配成饱和溶液需水的质量乙大于甲
利用溶解度计算(a为硝酸钾)
(1)80℃时,将KNO3饱和溶液降温至20℃,试分析溶液中的溶质、溶剂、饱和程度、浓稀等变化情况。
(2)若将269克80℃时KNO3饱和溶液降温至20℃,能析出多少晶体?
(3)80℃,将等质量溶剂的a、b、c 的饱和溶液分别降温至20℃,分析析出晶体的情况。
(1)80℃时,若将KNO3饱和溶液恒温蒸发10g水,能析出多少晶体?
(2)80℃,a、b、c的饱和溶液恒温蒸发等质量的水,比较析出晶体的大小关系。
(1)如何从KNO3溶液中获得KNO3固体?
(2)如何从NaCl溶液中获得NaCl固体?
(4)NaCl固体中混有少量KNO3固体,如何提纯?
(3) KNO3固体中混有少量NaCl固体,如何提纯?
(1)KNO3中混有少量NaCl的固体,提纯KNO3
a.先加热水溶解,蒸发浓缩,配制成KNO3热饱和溶液。b.降温结晶。c.过滤。d.洗涤晶体。 (用少量冷水洗涤——减少晶体溶解,造成损失; 饱和KNO3溶液洗涤——防止晶体溶解,造成损失)e.干燥
(2) NaCl中混有少量KNO3的固体,提纯NaCl
a.加水溶解,配成NaCl饱和溶液。b.加热蒸发结晶(残留少量水)c.趁热过滤。 (防止温度降低,KNO3溶解度降低析出)d.洗涤晶体。 (用少量洗涤——减少晶体溶解,造成损失; 饱和NaCl溶液洗涤——防止晶体溶解,造成损失)e.干燥
A(B)提纯A:降温结晶
B(A)提纯B:蒸发结晶
C(B)提纯C:升温结晶
(结晶法利用物质S随T变化的情况不同进行分离。)
①升高温度②加入少量丙物质③蒸发溶剂
①升高温度②加入少量c物质③蒸发溶剂
在t1℃时,a和c的溶解度相等均为20g
①降低温度②加入少量氯化钠③蒸发溶剂
化学源于生活, 服务于生活, 更能创造生活!
希望同学们都能成为新生活的创造者!
初中化学人教版九年级下册课题2 溶解度评课课件ppt: 这是一份初中化学人教版九年级下册<a href="/hx/tb_c9866_t3/?tag_id=26" target="_blank">课题2 溶解度评课课件ppt</a>,共20页。PPT课件主要包含了溶解性,固体溶解度,溶解度克,固体的溶解度曲线,蒸发结晶,点线交点的含义,课堂练习,气体的溶解度,探究气体的溶解度,第三节溶解度等内容,欢迎下载使用。
初中化学课题2 溶解度课堂教学课件ppt: 这是一份初中化学<a href="/hx/tb_c9866_t3/?tag_id=26" target="_blank">课题2 溶解度课堂教学课件ppt</a>,共18页。PPT课件主要包含了一溶液的分类,饱和溶液和不饱和溶液,动动手,浓度大,浓度小,知识点二结晶等内容,欢迎下载使用。
初中化学人教版九年级下册第九单元 溶液课题2 溶解度精品课件ppt: 这是一份初中化学人教版九年级下册<a href="/hx/tb_c9866_t3/?tag_id=26" target="_blank">第九单元 溶液课题2 溶解度精品课件ppt</a>,共60页。PPT课件主要包含了饱和溶液,不饱和溶液,曲线上点的含义,abc,bac等内容,欢迎下载使用。













