
2021学年第二单元 化学反应中的热测试题
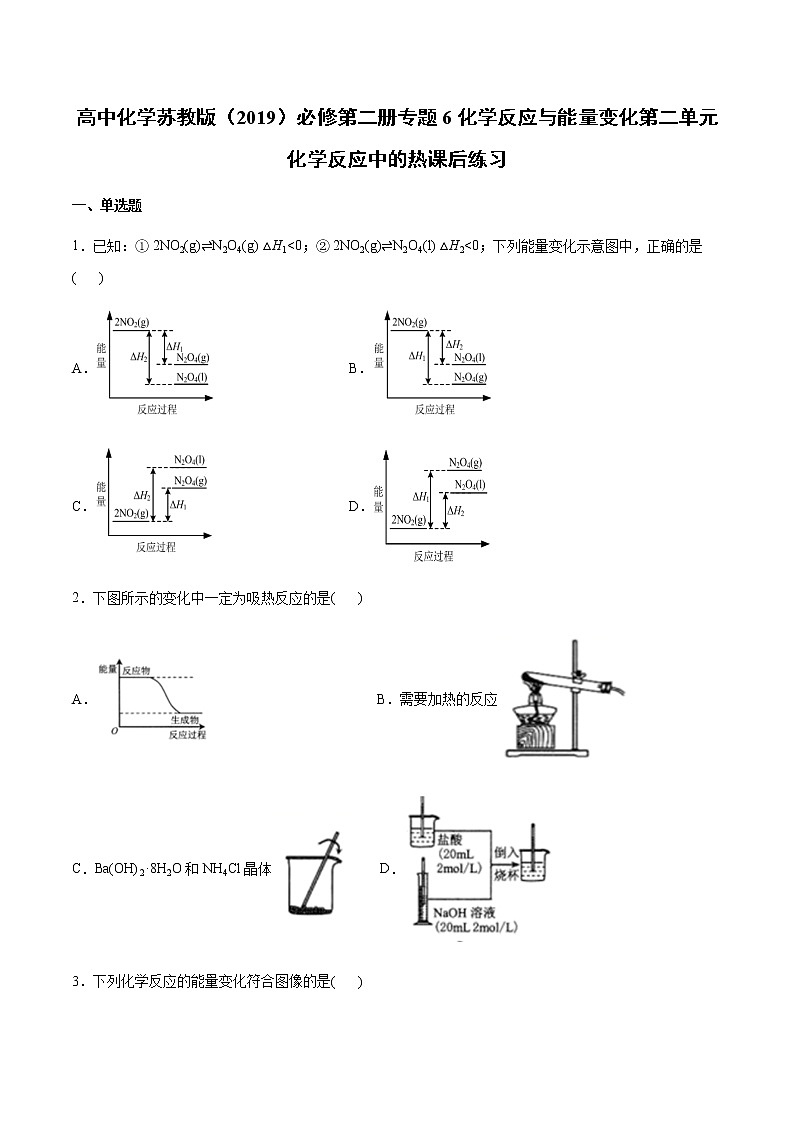
展开1.已知:① 2NO2(g)⇌N2O4(g) △H1<0;② 2NO2(g)⇌N2O4(l) △H2<0;下列能量变化示意图中,正确的是( )
A.B.
C.D.
2.下图所示的变化中一定为吸热反应的是( )
A. B.需要加热的反应
C.Ba(OH)2·8H2O和NH4Cl晶体D.
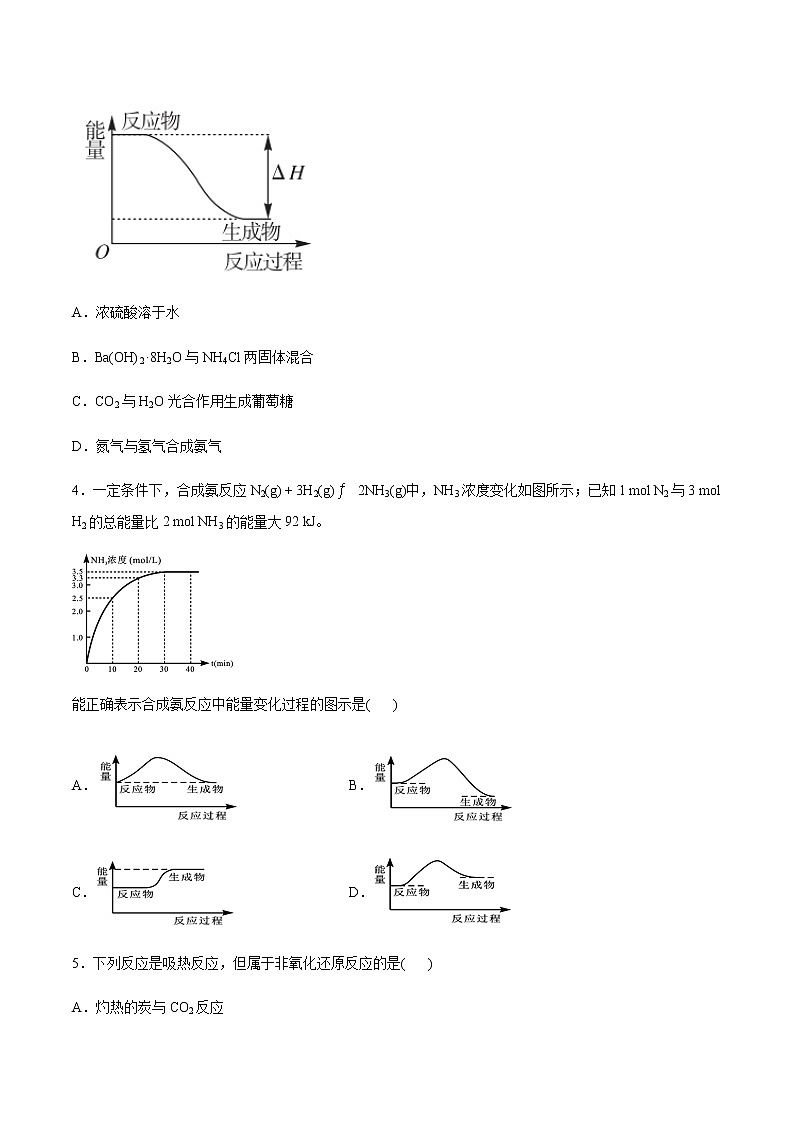
3.下列化学反应的能量变化符合图像的是( )
A.浓硫酸溶于水
B.Ba(OH)2·8H2O与NH4Cl两固体混合
C.CO2与H2O光合作用生成葡萄糖
D.氮气与氢气合成氨气
4.一定条件下,合成氨反应N2(g) + 3H2(g)2NH3(g)中,NH3浓度变化如图所示;已知1 ml N2与3 ml H2的总能量比2 ml NH3的能量大92 kJ。
能正确表示合成氨反应中能量变化过程的图示是( )
A.B.
C.D.
5.下列反应是吸热反应,但属于非氧化还原反应的是( )
A.灼热的炭与CO2反应
B.氧化铁与铝反应
C.钠与水的反应
D.Ba(OH)2·8H2O与NH4C1反应
6.下列属于吸热反应的是
A.B.C.D.
7.下列燃烧反应的反应热是燃烧热的是( )
A. B.
C. D.
8.下列反应既属于氧化还原反应,又是吸热反应的是( )
A.灼热的碳与CO2的反应B.铁片和稀硫酸的反应
C.Ba(OH)2·8H2O与NH4Cl的反应D.甲烷在氧气中的燃烧反应
9.氢气在氧气中燃烧,若生成等质量的气态水或液态水,所放出的热量前者与后者比较应是( )
A.前者大于后者B.前者小于后者C.前者等于后者D.无法比较
10.下列能表示乙炔燃烧热的热化学方程式的是 ( )
A.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(g) ΔH=a kJ·ml-1
B.C2H2(g)+O2(g)=2CO2(g)+H2O(l) ΔH=b kJ·ml-1
C.C2H2(g)+O2(g)= 2CO(g)+H2O(g) ΔH=c kJ·ml-1
D.C2H2(g)+O2(g)=2CO(g)+H2O(l) ΔH=d kJ·ml-1
11.乙醇的燃烧热△H=-1366.8kJ/ml,在25℃,101kPa时,23g乙醇充分燃烧后放出多少热量( )
A.683.4kJB.1366.8kJC.2733.6kJD.341.7kJ
12.下列反应中,生成物总能量高于反应物总能量的是( )
A.S+O2SO2 B.CaO+H2O=Ca(OH)2 C.C+CO22CO D.Zn+H2SO4=ZnSO4+H2↑
13.下列过程中△H大于零的是( )
A.碳的燃烧B.葡萄糖在人体内氧化分解
C.Ba(OH)2·8H2O与NH4Cl反应D.锌粒与稀H2SO4反应制取H2
14.热化学方程式C(s)+H2O(g)CO(g)+H2(g) △H =+131.3kJ/ml表示( )
A.碳和水反应吸收131.3kJ能量
B.1ml碳和1ml水反应生成一氧化碳和氢气并吸收131.3kJ热量
C.1ml固态碳和1ml水蒸气反应生成一氧化碳气体和氢气,并吸热131.3kJ
D.1个固态碳原子和1分子水蒸气反应吸热131.1kJ
15.下列反应中,ΔH>0反应的是( )
A.Zn与硫酸的反应B.生石灰与水的反应
C.Ba(OH)2·8H2O与NH4Cl的反应D.NaOH与盐酸的反应
二、原理综合题
16.如图所示,把试管放入盛有25℃时饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5mL盐酸于试管中。试回答下列问题:
(1)写出镁与盐酸反应的离子方程式:_____。
(2)实验中观察到的现象是:试管中有____放出,烧杯里的饱和石灰水变_____。
(3)由实验推知,MgCl2溶液和H2的总能量_____(填“大于”、“小于”、“等于”)镁片和盐酸的总能量。
(4)在下列因素中,影响镁片与盐酸反应速率的因素有____(填序号)
①盐酸的浓度 ②镁片的表面积 ③溶液的温度 ④Cl-的浓度
(5)发现H2的生成速率随时间t变化如下图,其中t1~t2速率变化的原因是_____;t2~t3速率变化的原因是_____。
17.为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应措施。化学反应的焓变通常用实验进行测定,也可进行理论推算。
(1)下列变化过程,属于放热反应的是___。
①浓H2SO4稀释;②酸碱中和反应;③H2在Cl2中燃烧;④固体NaOH溶于水;⑤液态水变成水蒸气;⑥碳高温条件下还原CO2。
(2)实验测得,标准状况下11.2L甲烷在氧气中充分燃烧生成液态水和二氧化碳气体时释放出akJ的热量,试写出表示甲烷摩尔燃烧焓的热化学方程式:___;
(3)捕碳技术(主要指捕获CO2在降低温室气体排放中具有重要的作用。目前NH3和(NH4)2CO3已经被用作工业捕碳剂,它们与CO2可发生如下反应:
反应Ⅰ:2NH3(l)+H2O(l)+CO2(g)(NH4)2CO3(aq)ΔH1
反应Ⅱ:NH3(l)+H2O(l)+CO2(g)NH4HCO3(aq)ΔH2
反应Ⅲ:(NH4)2CO3(aq)+H2O(l)+CO2(g)2NH4HCO3(aq)ΔH3
则ΔH3与ΔH1、ΔH2与之间的关系为ΔH3=___;
(4)已知反应N2(g)+3H2(g)2NH3(g)ΔH=akJ/ml,试根据表中所列键能数据估算a的值___。
18.热能是人类论今为止利用的主要能源之一。
(1)下列变化属于放热反应的是______(填序号)。
a.生石灰溶于水 b,浓硫酸稀释 c.溶于水
d.金属钠溶于水 e.碳酸钠溶于水 f.食物在人体内的缓慢氧化
(2)如图是某一反应的能量变化示意图。
①图中所示反应为___________(填“吸热”或“放热”)反应,逆反应的活化能为_____________。
②图示反应的热化学方程式为__________________________。
(3)已知,则反应的____。
化学键
H﹣H
N﹣H
N≡N
键能/kJ/ml
436
391
945
参考答案
1.A2.C3.D4.B5.D6.B7.C8.A9.B10.B11.A12.C13.C14.C15.C
16.Mg+2H+=Mg2++H2↑ 气泡 浑浊 小于 ①②③ 反应放热,温度升高,反应速率增大 溶液浓度减小,反应速率减小
17.②③ CH4(g)+2O2(g)=CO2(g)+2H2O(l)ΔH=-2akJ•ml-1 2ΔH2-ΔH1 -93
18.adf 放热
高中化学苏教版 (2019)必修 第二册第二单元 化学反应中的热练习题: 这是一份高中化学苏教版 (2019)必修 第二册第二单元 化学反应中的热练习题,共8页。试卷主要包含了单选题,实验题,计算题,填空题等内容,欢迎下载使用。
苏教版 (2019)必修 第二册第二单元 化学反应中的热课堂检测: 这是一份苏教版 (2019)必修 第二册第二单元 化学反应中的热课堂检测,共13页。试卷主要包含了单选题,填空题,实验题,原理综合题等内容,欢迎下载使用。
高中化学第二单元 化学反应中的热课时作业: 这是一份高中化学第二单元 化学反应中的热课时作业,共10页。试卷主要包含了单选题,实验题,计算题等内容,欢迎下载使用。













