




人教版 (新课标)必修2第一节 元素周期表说课课件ppt
展开1.掌握碱金属单质的主要性质及其递变规律。2.初步掌握主族元素原子结构与元素性质的内在联系。
本课设计主线:原子结构——化学性质——物理性质——总结升华。课题以设问的形式引导学生观察碱金属原子结构的异同点,并根据结构推测化学性质,接着用实验、资料分析的方法验证其相似性及递变性;从而总结出碱金属元素化学性质的相似与递变规律。之后阅读教材碱金属的物理性质,归纳物理性质的相似和递变规律。最后采用表格的形式归纳总结碱金属的结构、性质的递变规律,并设计精选习题培养学生应用知识的能力。 碱金属化学性质的学习,注重从结构决定性质的角度入手,结合结构推测其化学性质,并用实验、资料分析的方法验证其化学性质的相似性及递变性。碱金属物理性质的学习采用学生自主学习阅读教材并归纳,有助于锻炼学生比较、分析归纳总结的能力。
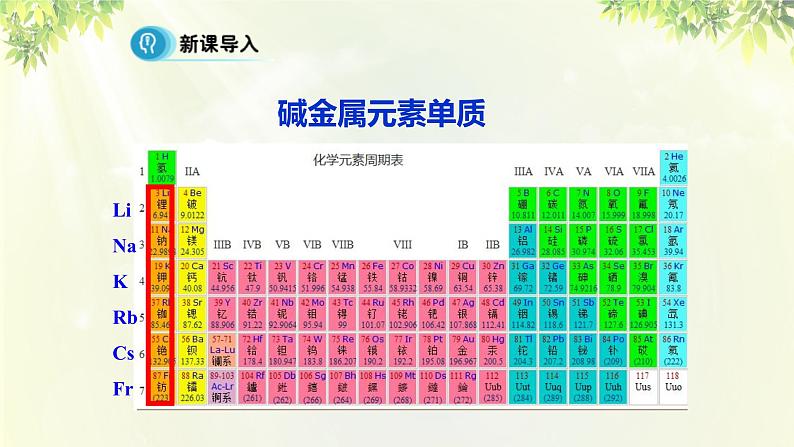
LiNaKRbCsFr
1.元素的原子结构和元素的性质之间有什么关系呢?2.我们把ⅠA 族(除氢)称为碱金属,为什么要把它们编在一个族呢?
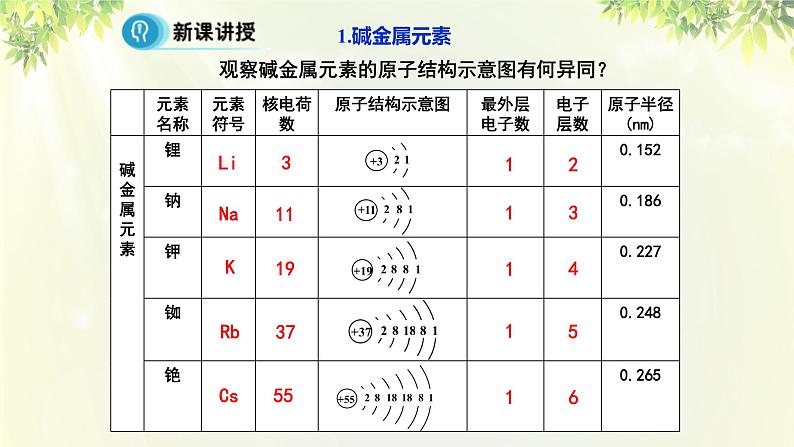
观察碱金属元素的原子结构示意图有何异同?
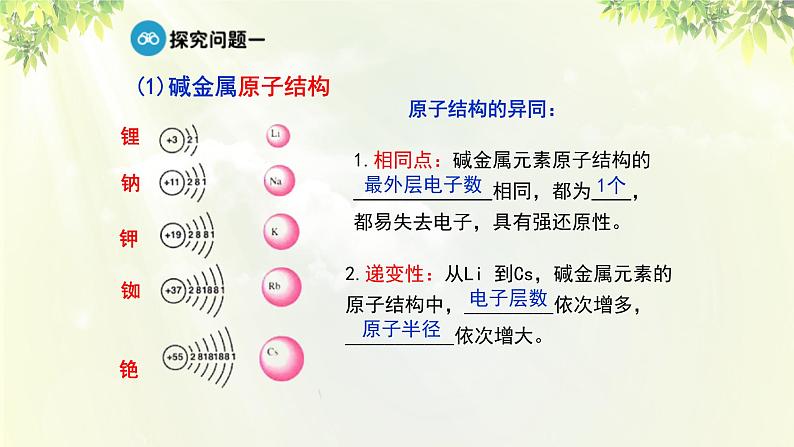
1.相同点:碱金属元素原子结构的______________相同,都为____,都易失去电子,具有强还原性。
2.递变性:从Li 到Cs,碱金属元素的原子结构中,_________依次增多,___________依次增大。
结构决定性质,可否从碱金属原子的结构角度推测其化学性质如何?又是否完全相同?
(2)碱金属单质的化学性质
剧烈燃烧,火焰呈 色
从Li到Cs,随电子层数的递增,还原性(金属性)逐渐增强.
浮、熔、游、响、红,有微弱爆炸
钠、钾与水反应的实验对比
请描述钠与水反应的实验操作及现象;
从Li到Cs,随电子层数的递增,还原性(金属性)逐渐增强。
(1)碱金属元素结构和化学性质的相似性和递变性
最外层上都只有一个电子
1) 易失去电子,表现出强还原性
2)化合物中均显+1价
核对最外层电子的引力↓
在元素周期表中,同主族元素从上到下原子核外电子层数依次______,原子半径逐渐______,失电子能力逐渐______,金属性逐渐______。
还原性:Li < Na < K < Rb < Cs
氧化性:Li +< Na+ < K+ < Rb+ < Cs+
(1)碱金属单质的物理性质
阅读P7,试着归纳碱金属物理性质的相似性和递变性
表1-1 碱金属的主要性质
最轻的金属,保存在石蜡里
密度反常,比钠的密度小
碱金属物理性质的递变规律
均为银白色(Cs略带金色)
1.锂是世界上最轻的金属,它属于碱金属的一种。下列关于碱金属的说法正确的是( )A.和锂同一主族的都是金属元素B.Na+比Li多一个电子层C.Li+、Na+、K+、Rb+的最外层都有8个电子D.Li是碱金属中原子半径最小的原子
Na+有两个电子层,Li有两个电子层
Li+最外层只有2个电子
2.下列对碱金属性质的叙述中正确的是( )A.碱金属元素的单质具有强还原性,可置换出硫酸铜溶液中的铜单质B.单质在空气中燃烧生成的都是过氧化物C.碱金属单质与水反应生成碱和氢气D.单质熔、沸点随着原子序数递增而升高
Li燃烧后生成物只有Li2O
碱金属单质还原性强,会首先与水反应
3.下列关于碱金属某些性质的排序中,正确的是( )A.还原性:Li>Na>K>Rb>CsB.密度:Li
从上到下,密度逐渐增大(K除外)
碱金属从上到下,熔沸点逐渐降低
人教版 (2019)第四章 物质结构 元素周期律第二节 元素周期律课前预习课件ppt: 这是一份人教版 (2019)第四章 物质结构 元素周期律第二节 元素周期律课前预习课件ppt,共55页。PPT课件主要包含了典例剖析,答案A等内容,欢迎下载使用。
人教版 (新课标)必修2第三节 化学键评课课件ppt: 这是一份人教版 (新课标)必修2第三节 化学键评课课件ppt,共18页。PPT课件主要包含了种元素,万种物质,元素组成,原子分子构成,化学键,Cl-,Na1Cl1,Na+Cl,Na2S1,Na+S等内容,欢迎下载使用。
人教版 (新课标)必修2第二节 元素周期律示范课ppt课件: 这是一份人教版 (新课标)必修2第二节 元素周期律示范课ppt课件,共14页。PPT课件主要包含了了解两性元素,结构决定位置,原子得失电子的能力,位置决定性质,氧化性增强,非金属性逐渐增强,金属性逐渐增强,原子半径逐渐增大,还原性逐渐增强,原子半径逐渐减小等内容,欢迎下载使用。













