





高中化学人教版 (新课标)必修2第二节 元素周期律教学ppt课件
展开1、掌握原子核外电子的排布规律
2、元素性质与原子结构的关系
本课设计主线:原子结构——原子结构递变规律——元素性质递变规律——课堂检测。首先借用“核外电子运动的视频导入课堂,并发出与本课知识相关的设问,讲述原子核外电子的排布,从电子层、电子的能量及电子排布三个角度共同分析,总结出原子核外电子的排布规律;同时依据材料总结原子的电子层排布、原子半径及化合价的排布规律,从而引出问题:结构与性质的关系,接着通过实验或数据,总结第同一周期或同一主族的元素金属性或非金属的递变规律,最后通过课堂练习巩固本课所学知识。 在讲述金属性及非金属的递变规律时,一定要依据实验或数据,同时强调一定要学生明确判断金属性或非金属性的标准,让学生区别氢化物或最高价氧化物对应水化物的区别。
结论: 1、在一个体积小、相对空间大(但绝对空间小)的原子核外作高速运动(速度接近光速)。 2、电子的运动是有一定规则的。
人们将电子运动的区域简化为不连续的壳层,称之为“电子层”。
所有电子都具有一定的能量,在多电子原子里,各电子所具有的能量不尽相同,能量低的电子在离核较近的区域运动,能量较高的电子在离核较远的区域运动。
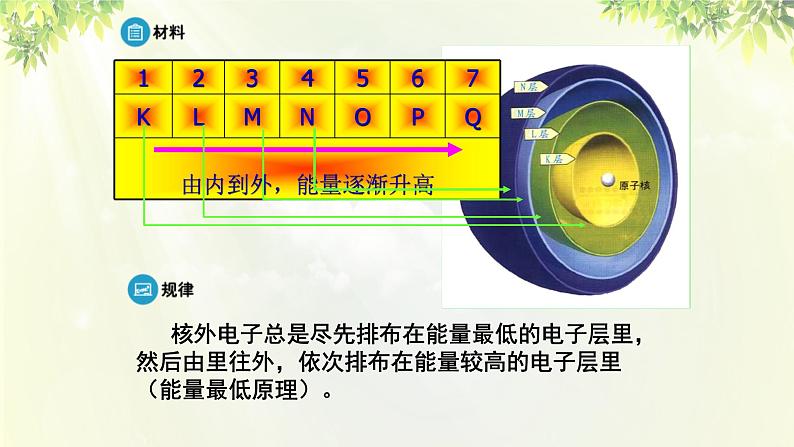
3、核外电子的排布规律(分析表1-2)
一、原子核外电子的排布
核外电子总是尽先排布在能量最低的电子层里,然后由里往外,依次排布在能量较高的电子层里(能量最低原理)。
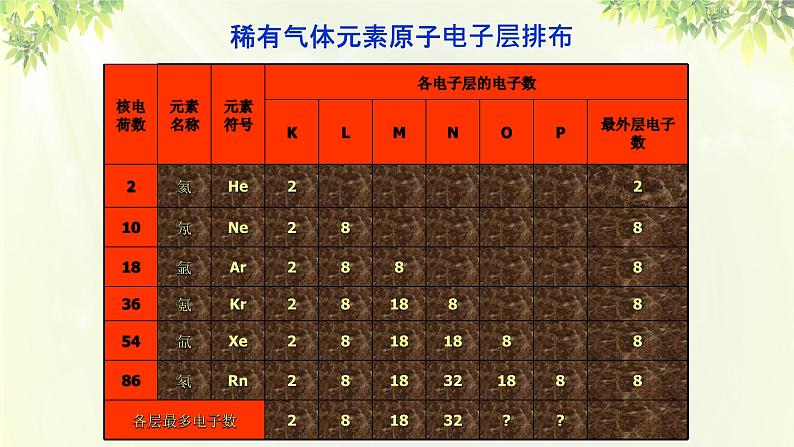
稀有气体元素原子电子层排布
(1)各电子层最多能容纳的电子数为 2n2
(2)最外层电子数不能超过 8(当K层为最外层时不能超过 2 )。
(3)次外层电子数不能超过 18 ,倒数第三层电子数不能超过 32 。
(3)次外层电子数不能超过 18 ,倒数第三层电子数能超过 32 。
(4)核外电子总是尽先排布在能量最低的电子层里,然后由里往外,依次排布在能量较高的电子层里(能量最低原理)。
a、四条规律相互制约b、最外电子层中排满 8 个电子(He为2个电子)时,为相对稳定结构,其它为不稳定结构
1、判断下列原子结构示意图是否正确?为什么?
2、根据下列叙述,写出元素名称并画出原子结构示意图。(1)A元素原子核外M层电子数是L层电子数的1/2;______(2)B元素原子的最外层电子数是次外层电子数的1.5倍;______(3)C元素的次外层电子数是最外层电子数的1/4;________
表5-5 1~18号元素的核外电子排布、原子半径和主要化合价
结论:随着原子序数的递增,元素原子的最外层电子排布呈现周期性变化。
结论:随着原子序数的递增,元素原子半径呈现周期性变化。
主要化合价:正价+1→0
主要化合价:正价+1→+5,负价:-4 →-1 → 0
主要化合价:正价+1→+7,负价:-4 →-1→0
结论:随着原子序数的递增,元素主要化合价呈现周期性变化。
为什么随原子序数的递增,元素原子的电子层排布、原子半径、化合价呈现周期性变化呢?
随原子序数的递增,元素原子核外电子排布的周期性变化,决定了原子半径、化合价呈现周期性变化。
元素的金属性和非金属性是否也随原子序数的变化呈现周期性变化呢?
元素的金属性和非金属性的强弱根据什么来判断?
①金属与水或酸反应越容易,金属性越强;②最高价氧化物对应的水化物(氢氧化物) 碱性越强,金属性越强;③金属单质与某些盐溶液反应置换另一金属。
元素金属性强弱判断依据:
①非金属与H2化合越容易,非金属性越强; ②气态氢化物越稳定, 非金属性越强; ③最高价氧化物对应的水化物(含氧酸) 酸性越强,非金属性越强;④非金属与某些盐溶液反应置换另一非金属
元素非金属性强弱判断依据:
(1)镁与冷水和热水反应比较
(1)比较钠比镁与水反应的难易程度?
加热前,镁条表面附着 ,加热沸腾后有 冒出,溶液变 色。
镁与铝均能与盐酸反应产生气泡。但镁反应比铝剧烈。
(2)镁与铝与盐酸反应比较
有大量气泡产生,试管烫手,反应速度很快。
有大量气泡产生,试管烫手,反应速度快。
比较镁和铝与盐酸反应的难易程度?
NaOH( )
Al(OH)3( )
浮于水面,熔成小球,四处游动,嘶嘶作响,溶液变红;与酸反应更为剧烈。
所以: Na Mg Al 金属性逐渐 .
常温下和加热时,遇水无明显现象;与酸反应剧烈,放出无色气体。
上述实验证明,第三周期元素金属性、非金属性的递变规律:
Na Mg Al Si P S Cl
金属性逐渐 ,非金属性逐渐 。
对其他周期元素性质进行研究,也可以得到类似的结论。
∴ 同一周期元素,从左到右, 金属性逐渐减弱,非金属性逐渐增强。
比较第三周期非金属与氢气反应条件及含氧酸的酸性强弱 (P16)
元素周期表中元素性质递变规律
从+1 -- +7或-4 -- -1
氧化性增强,还原性减弱
还原性增强,氧化性减弱
碱性逐渐减弱,酸性逐渐增强
碱性逐渐增强,酸性逐渐减弱
生成由难渐易稳定性逐渐增强
生成由易渐难稳定性逐渐减弱
元素原子的最外层电子排布
+1→+7-4→-1→0
金属性减弱非金属性增强
随着原子序数的递增,元素的性质呈现周期性变化 ,这叫做元素周期律。
1.某元素原子核外L层电子数是其它层电子数之和的2倍,则该元素的核电荷数为( ) A.6 B.8 C.12 D.16
高中人教版 (新课标)第二节 元素周期律集体备课ppt课件: 这是一份高中人教版 (新课标)第二节 元素周期律集体备课ppt课件,共29页。PPT课件主要包含了原子核,核外电子,同位素,元素周期律,主族元素的名称,原子半径,失电子,得电子,金属性,非金属性等内容,欢迎下载使用。
化学必修2第二节 元素周期律课文内容ppt课件: 这是一份化学必修2第二节 元素周期律课文内容ppt课件,共60页。PPT课件主要包含了周期表的结构,三短四长七不全,七主七副一八圈,NaCuFeBrNe等内容,欢迎下载使用。
人教版 (新课标)必修2第三节 化学键评课课件ppt: 这是一份人教版 (新课标)必修2第三节 化学键评课课件ppt,共18页。PPT课件主要包含了种元素,万种物质,元素组成,原子分子构成,化学键,Cl-,Na1Cl1,Na+Cl,Na2S1,Na+S等内容,欢迎下载使用。













