



人教版 (2019)第四章 物质结构 元素周期律第二节 元素周期律课前预习课件ppt
展开一、元素周期表1.元素周期表的发展历程。(1)诞生:1869年,俄国化学家 门捷列夫 将元素按照 相对原子质量 由小到大的顺序排列,将化学性质相似的元素放在一个纵列,制出了第一张元素周期表。 (2)演变:为未知元素留下的空位先后被填满。(3)现行:元素的排序依据由相对原子质量改为原子的 核电荷数 。
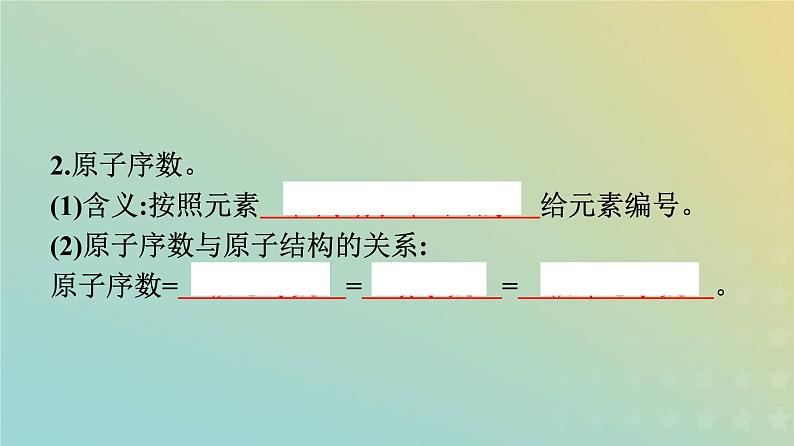
2.原子序数。(1)含义:按照元素 在周期表中的顺序 给元素编号。 (2)原子序数与原子结构的关系:原子序数= 核电荷数 = 质子数 = 核外电子数 。
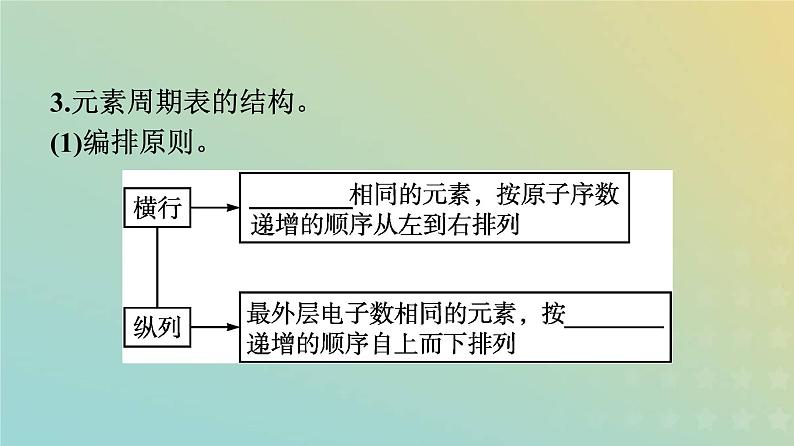
3.元素周期表的结构。(1)编排原则。
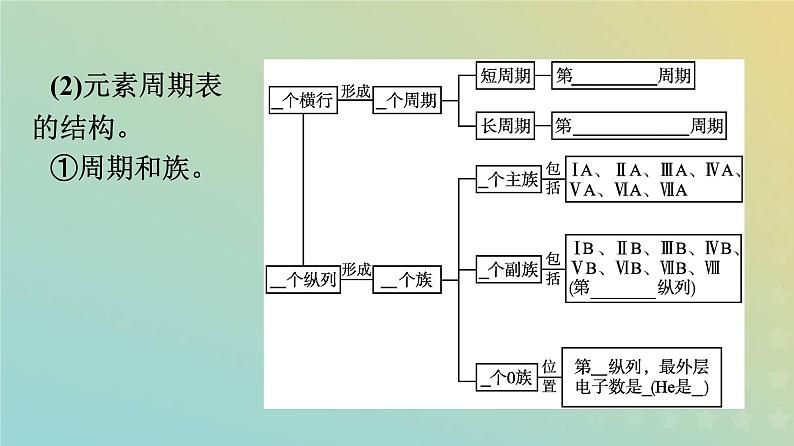
(2)元素周期表的结构。①周期和族。
②常见族的特别名称。
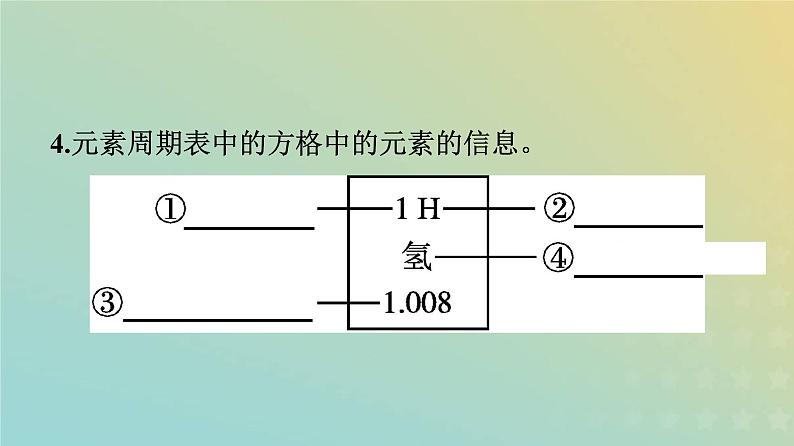
4.元素周期表中的方格中的元素的信息。
微判断1(1)氧元素在元素周期表中的位置是第二周期第ⅥA族。( )(2)现行元素周期表是按相对原子质量由小到大的顺序排列的。( )(3)元素周期表中有7个横行,即7个周期;有18个纵列,即18个族。( )(4)最外层电子数相同的元素都在同一族。( )(5)同族元素的最外层电子数一定相同。( )
(6)每一周期都是从碱金属元素开始,至稀有气体元素结束。( )(7)第ⅠA族元素叫做碱金属元素。( )(8)主族元素都是由短周期元素和长周期元素共同组成的。( )
二、核素1.元素:具有相同 质子数(核电荷数) 的一类原子的总称。 同种元素原子的原子核中 质子数 是相同的。 2.核素:具有一定数目 质子 和一定数目 中子 的一种原子叫做核素。如1H、2H、3H就各为氢元素的一种核素。 3.核素(原子)的表示方法:
4.同位素:(1)定义。 质子数 相同而 中子数 不同的同一元素的不同原子互称同位素(即同一元素的不同 核素 互称为同位素)。下表即为氢元素的不同核素,它们互称同位素。
(2)同位素的特征。①同一种元素的各种同位素的化学性质 几乎完全相同 ;物理性质略有差异。 ②天然存在的同位素,相互之间保持一定的 比率 。
③利用放射性同位素释放的射线育种、 给金属探伤 、诊断和治疗疾病等。
(3)同位素的用途。
微判断2(1)不同元素的核素的质量数一定不同。( )
一 元素周期表重难归纳1.元素周期表的结构。元素周期表中7个横行对应7个周期,18个纵列对应16个族(8、9、10三个纵列共同组成第Ⅷ族)。元素所在的周期序数=核外电子层数主族元素所在主族序数=最外层电子数
2.元素周期表的简单应用。(1)短周期中族序数与周期序数存在特殊关系的元素。
(2)利用离子电子层结构相同的“阴上阳下”规律推断对应元素在周期表中的位置。如aX(n+1)+、bYn+、cZ(n+1)-、dMn-的电子层结构相同,在周期表中的位置关系为:
(3)据原子序数确定元素在周期表中位置的方法——0族元素定位法。①明确0族元素信息。
②比大小定周期。比较该元素的原子序数与0族元素的原子序数大小,找出与其相邻的0族元素,那么该元素就和原子序数大的0族元素处于同一周期。
③求差值定族序数。a.若某元素原子序数比相应的0族元素大1或2,则该元素应处在0族元素所在周期的下一个周期的第ⅠA族或第ⅡA族。b.若比相应的0族元素小1~5时,则该元素应处在同周期的第ⅦA~ⅢA族。c.若差值为其他数时,则由相应差值找出相应的族。
(4)同周期第ⅡA族和第ⅢA族元素的原子序数差。
(5)同主族相邻两元素原子序数之差的情况。①若为第ⅠA、第ⅡA族元素,则原子序数之差等于上周期元素所在周期的元素种类数。②若为ⅢA族至0族元素,则原子序数之差等于下周期元素所在周期的元素种类数。(6)同主族不相邻两元素的原子序数的差。元素周期表中第一周期至第七周期的元素种类数分别是2,8,8,18,18,32,32,故同主族不相邻的两种元素的原子序数的差是这几个数的和或差,如1H和19K的原子序数差是2+8+8=18。
同一主族元素原子的最外层电子数相同,那么Fe最外层有2个电子,一定位于第ⅡA族吗?提示:第ⅡA族的元素最外层一定有2个电子,但最外层有2个电子的元素不一定位于第ⅡA族。Fe属于副族元素。
典例剖析已知X、Y、Z三种主族元素在周期表中的位置如图所示,设X的原子序数为a。则下列说法不正确的是( )。A.Y与Z的原子序数之和可能为2aB.Y的原子序数可能为a-17C.Z的原子序数可能为a+31D.X、Y、Z一定为短周期元素
答案:D解析:由题给信息可知,X、Y、Z只能位于元素周期表中过渡元素区域的右边。若X位于第四周期,则Y的原子序数为a-17,Z的原子序数为a+17,Y与Z的原子序数之和为2a,A、B两项正确。若X位于第五、第六周期,Z的原子序数为a+31,C项正确。X、Y、Z为主族元素,Y一定不在第一周期,则Z肯定是长周期元素,D项错误。
学以致用1.短周期元素A、B、C的位置如右图所示,已知B、C两元素所在族序数之和是A元素所在族序数的2倍,B、C两元素的原子序数之和是A元素原子序数的4倍,则A、B、C依次是( )。A.Be、Na、AlB.C、Al、PC.O、P、ClD.B、Mg、Si
答案:C解析:设空格处元素为X,其原子序数为x,则据题意知A、B、C的原子序数的关系:(x-1)+(x+1)=(x-8)×4,解得x=16,所以A、B、C分别为O、P、Cl。
2.元素X的原子有3个电子层,最外层有4个电子。这种元素位于周期表的( )。A.第四周期第ⅢA族B.第四周期第ⅦA族C.第三周期第ⅣB族D.第三周期第ⅣA族答案:D解析:周期序数=电子层数,主族元素族序数=最外层电子数。
二 元素、核素、同位素、同素异形体的区别和联系重难归纳1.元素、核素、同位素、同素异形体的区别。
2.元素、核素、同位素、同素异形体的联系。
同位素的三同、三不同:三同:同种元素(同质子数、同核电荷数、同电子数),相同位置(在周期表中),化学性质几乎相同。三不同:不同种原子(中子数不同、质量数不同),不同的物理性质,不同的原子个数百分比。
核武器是利用能自持进行核裂变或聚变反应瞬时释放的巨大能量,产生爆炸作用,并具有大规模毁伤破坏效应的武器的总称。其中主要利用铀235(235U)或钚239(239Pu)等重原子核的裂变链式反应原理制成的裂变武器,通常称为原子弹;主要利用重氢(2H,氘)或超重氢(3H,氚)等轻原子核的热核反应原理制成的热核武器或聚变武器,通常称为氢弹。
(1)235U与234U、238U属于什么关系?2H2和3H2互为同位素吗?(2)结合核外电子排布讨论,互称同位素的不同核素为什么具有几乎完全相同的化学性质?(3)核素种类与质子数、中子数和质量数有何关系?
(2)元素的相对原子质量:按照该元素各种核素所占的一定百分比(即丰度)计算出来的平均值。如:
(2)元素相对原子质量:Ar=Ar(A)·a%+Ar(B)·b%+ Ar(C)·c% +……Ar(A)、Ar(B)、Ar(C )分别表示各核素的相对原子质量,a%、b%、c%表示自然界中该元素各核素的原子个数百分比(丰度)。
学以致用1 具有放射性,从而对人体产生伤害。该原子的中子数和质子数之差是( )。A.136D.222答案:B解析: 的质子数为86,中子数=222-86=136,两者之差为136-86=50。
2.下列说法中不正确的是( )。①质子数相同的粒子一定属于同一种元素②同位素的性质几乎完全相同③质子数相同,电子数也相同的两种粒子,不可能是一种分子和一种离子④电子数相同的粒子不一定属于同一种元素⑤一种元素不可能形成不同的单质⑥某种元素的相对原子质量取整数,就是其质量数A.①②⑤⑥ B.①②④⑤ C.②③⑤⑥ D.③④⑤⑥
答案:A解析:①质子数相同的原子一定属于同一种元素,不正确;②同位素的化学性质几乎完全相同,物理性质不同,不正确;③由于中性粒子中,质子数=核外电子数,离子中,质子数≠核外电子数,所以质子数相同,电子数也相同的粒子,不可能是一种分子和一种离子,正确;④电子数相同的粒子不一定属于同一种元素,例如O2-和F-等都是10电子粒子,正确;⑤一种元素可能形成不同的单质,如O2和O3,不正确;⑥元素没有质量数,不正确。
1.下列说法正确的是( )。A.常用元素周期表中元素排序的依据是原子的核电荷数B.元素周期表有16个纵列,也就是16个族C.原子的最外层电子数相同的元素,一定属于同一族D.电子层数相同的粒子,对应元素一定属于同一周期答案:A解析:元素周期表中有18个纵列,16个族,8、9、10三个纵列共同组成第Ⅷ族;Be和He的最外层电子数都是2,但不属于同一族;Ne和Na+的电子层数都是2,但不属于同一周期。
2.下列各图若为元素周期表的一部分(表中数字代表原子序数),其中合理的是( )。
答案:D解析:本题要求熟记元素周期表的结构,知道1~18号元素在周期表中的具体位置。解题时可根据稀有气体元素2号、10号元素应在周期表的最右端和3号元素在周期表的最左端排除A、B、C三项。
3.如果n为第ⅡA族中某元素的原子序数,则原子序数为(n+1)的元素可能位于( )。A.第ⅢA族或第ⅢB族B.第ⅣA族C.第ⅠB族D.第ⅠA族答案:A解析:在元素周期表中,第二、第三周期中第ⅡA族与第ⅢA族元素原子序数相差1,在第四、第五、第六、第七周期中,第ⅡA族与第ⅢB族相邻,故原子序数为(n+1)的元素位于第ⅢA族或第ⅢB族,A项正确。
4.下列描述中,不正确的是( )。A.14N与15N具有相同的质子数B.18O与17O具有相同的电子数C.18O与19F具有相同的中子数D.12C与13C具有相同的质量数答案:D解析:14N与15N的质子数都是7;18O和17O的电子数都是8;18O和19F的中子数都是10;12C与13C的质量数分别为12和13。
5.下表符号中“2”的含义正确的一组是( )。
答案:B解析: 中2表示质量数,2He中2表示质子数,Cl2中2表示含有2个氯原子,Ca2+中的2表示带2个电荷。
6.A、B、C、D为短周期元素,在元素周期表中所处的位置关系如下图所示,A、C两种元素的原子核外电子数之和等于B元素原子的质子数。(1)分别写出A、B、C、D四种元素的名称 、 、 、 。 (2)B元素位于元素周期表中第 周期第 族。 (3)D元素的单质与水反应的化学方程式为 。
高中化学人教版 (2019)必修 第一册第一节 原子结构与元素周期表教课ppt课件: 这是一份高中化学人教版 (2019)必修 第一册第一节 原子结构与元素周期表教课ppt课件,共36页。PPT课件主要包含了自主预习·悟新知,元素周期表,电子层数目,原子序数,最外层电子数,电子层数,微点拨,元素和核素,同位素,中子数等内容,欢迎下载使用。
高中化学人教版 (2019)必修 第一册第二节 元素周期律课堂教学ppt课件: 这是一份高中化学人教版 (2019)必修 第一册第二节 元素周期律课堂教学ppt课件
人教版 (2019)必修 第一册第二节 元素周期律说课课件ppt: 这是一份人教版 (2019)必修 第一册第二节 元素周期律说课课件ppt,共42页。PPT课件主要包含了自主预习·新知导学,合作探究·释疑解惑,课堂小结,2特点,2联系等内容,欢迎下载使用。













