





高中化学人教版 (2019)必修 第一册第二章 海水中的重要元素——钠和氯第二节 氯及其化合物评课ppt课件
展开一、氯气(chlrine)
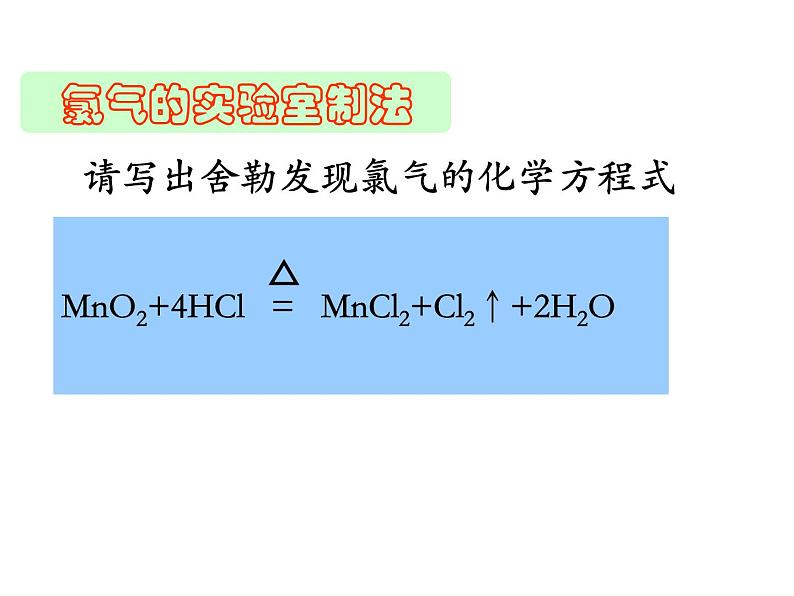
⒈氯气的发现和确认:——舍勒
请写出舍勒发现氯气的化学方程式
MnO2 + HCl --
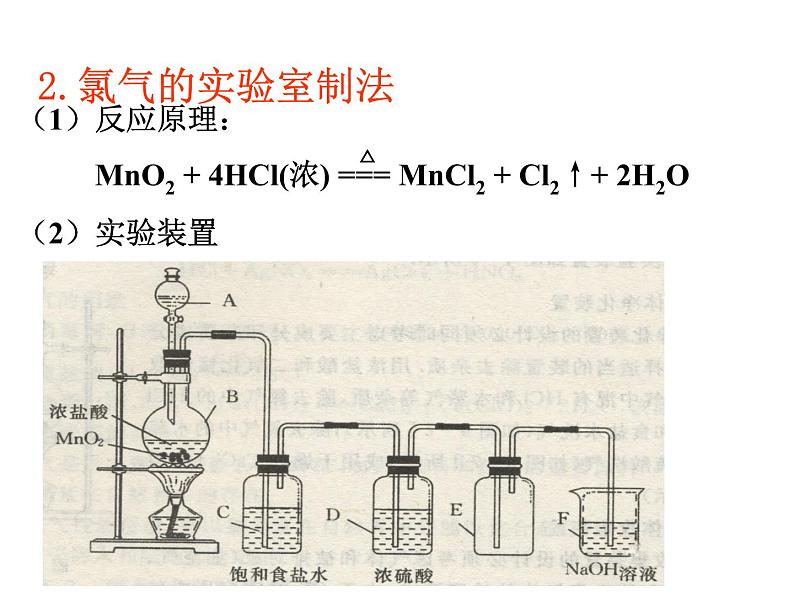
①气体发生装置:固—液加热制气装置
②气体净化装置:饱和食盐水(除HCl)→浓硫酸(除水蒸气)
③气体收集装置:向上排空气法
④尾气处理装置:用氢氧化钠溶液吸收尾气
熔点 沸点溶解性密度 硬度
最外层有7个电子,易得1个电子 氯元素显-1价
通常状况下,氯气是一种黄绿色有刺激性 气味的有毒气体,比空气重,易液化,能溶于 水(1:2)
问题: 根据氯的原子结构分析氯气表现什么性质?
练习: 写出Cl2与Na、Fe、Al、Cu反应的化学方程式。
2Fe + 3Cl2 = 2FeCl3
⑵ Cl2与非金属的反应
①与H2的反应 实验: H2在Cl2中燃烧(实验4-3) 现象: 原理:
无色液体 白色固体
②与P的反应
⒈铜在氯气中燃烧与氢气在氯气中燃烧有什么共同点?⒉燃烧是否一定有氧气参加?⒊什么叫燃烧?
燃烧(广义):剧烈的发光发热的化学反应
Cl2 + H2O = HCl + HClO
实验 ①干燥的红纸放入Cl2中 现象: ②润湿的红纸放入Cl2中 现象: 结论:
潮湿的Cl2具有漂白性,干燥的Cl2没有 漂白性,起漂白作用的是HClO
打开自来水时为何偶尔会闻到一股刺激性气味?
⑶ Cl2与H2O的反应
思考:液氯和氯水是同一物质吗?本质有何区别?
新制的氯水主要成份: H2O、Cl2 、HCl、HClO
思考:根据Cl2与H2O反应的生成物分析,如果把 Cl2通入NaOH溶液中会有什么情况出现呢?写出 反应方程式。
5. 化学性质⑶ Cl2与H2O的反应
⑷Cl2与碱的反应Cl2+2NaOH =NaCl + NaClO + H2O
Cl2+Ca(OH)2 —— ?
2Cl2+2Ca(OH)2 = CaCl2 + Ca(ClO)2 +2H2O
氯气可直接做漂白剂,但日常使用的却是漂 白液、漂白粉或漂白精等,那么漂白粉等的漂白 原理如何?工业上为什么不直接用HClO而要制成 Ca(ClO)2呢?
思考:根据Cl2与H2O反应的生成物分析,如果把Cl2通入NaOH溶液中会有什么情况出现呢?写出反应方程式。
5. 化学性质 ⑶ Cl2与H2O的反应
以NaClO为有效成份的漂白用的液体
CaCl2和Ca(ClO)2的混合物,其中有 效成份是Ca(ClO)2
含Ca(ClO)2较高浓度的漂白性物质
⑶ Cl2与H2O的反应
Cl2+2NaOH =NaCl + NaClO + H2O
结论:Cl2是活泼的非金属单质,常作氧化剂,氯元素在自然界中只能以化合物形式存在,应用很广泛。
⑴ Cl2与金属的反应
⑵ Cl2与H2的反应
实验:P85 实验4-6
解释原因,写方程式,总结Cl-的检验方法。
加入HNO3酸化的AgNO3溶液产生白色沉淀,证明Cl-存在。
Ag++ Cl- = AgCl↓
2.HNO3酸化的作用:
F Cl Br I
F2 > Cl2 > Br2 > I2
2Na + Cl2 = 2NaCl
Cu + Cl2 = CuCl2
2Al + 3Cl2 = 2AlCl3
高中化学第二节 氯及其化合物说课ppt课件: 这是一份高中化学第二节 氯及其化合物说课ppt课件,共41页。PPT课件主要包含了核心素养发展目标,氯气的性质,化学性质,物理性质,黄绿色气体,刺激性,溶解性,能溶于水12,原子结构,非金属单质等内容,欢迎下载使用。
高中化学必修一 专题2.2.1 氯气的性质: 这是一份高中化学必修一 专题2.2.1 氯气的性质,共23页。
高中化学必修一 2.2.1 氯气的性质课件: 这是一份高中化学必修一 2.2.1 氯气的性质课件,共20页。













