




人教版初中化学九下:复分解反应 专题复习 课件
展开小明不慎将厕所清洁剂(含有盐酸)洒落在大理石(主要成分碳酸钙)的地面上,结果发现冒出很多的气泡,他觉得很好奇,就去请教上初三的哥哥想弄明白到底是怎么回事,如果你是小明的哥哥或者姐姐能不能帮助他解释这个现象呢?
由两种化合物互相交换成分,生成另外两种化合物的反应。
一、复分解反应的概念:
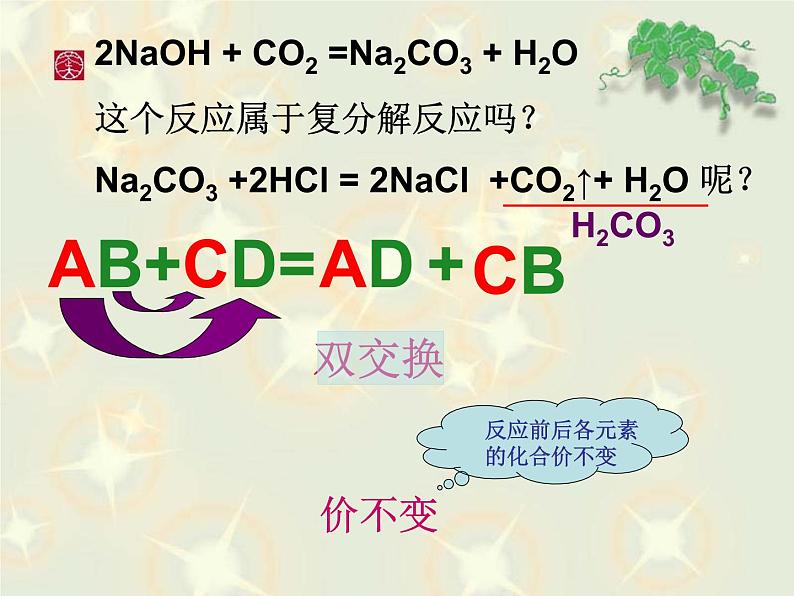
2NaOH + CO2 =Na2CO3 + H2O这个反应属于复分解反应吗?Na2CO3 +2HCl = 2NaCl +CO2↑+ H2O 呢?
AB+CD= +
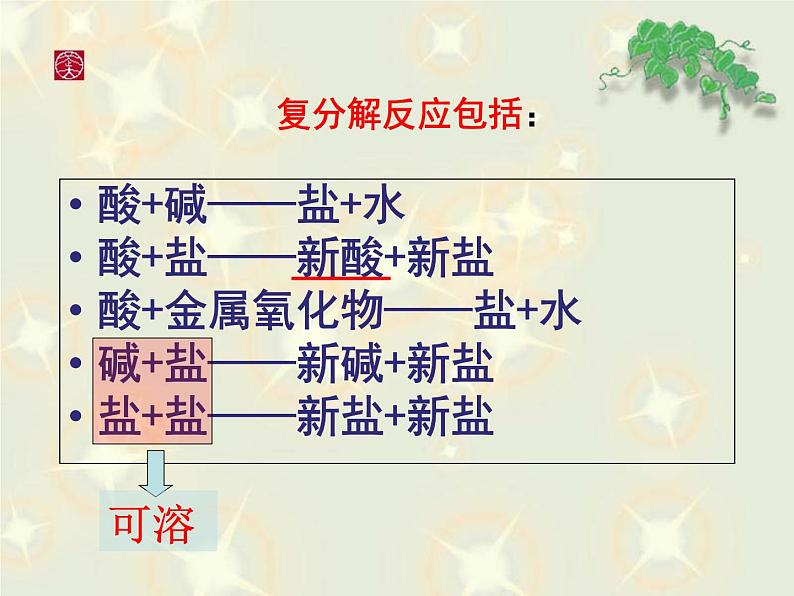
酸+碱——盐+水酸+盐——新酸+新盐酸+金属氧化物——盐+水碱+盐——新碱+新盐盐+盐——新盐+新盐
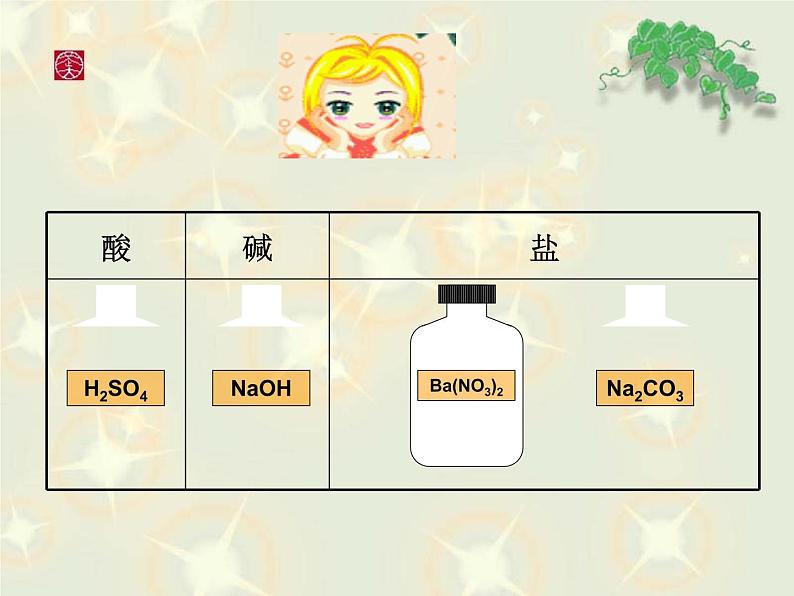
比一比:看看哪组能利用上述药品找出能发生复分解反应的最多组合;并说出判断它是否反应的依据是什么。(填写在学案中的第一部分)
H2SO4、NaOH、Na2CO3、Ba(NO3)2
同时把式子(1)~(8) 交换成分写出化学式
Na+、CO3 2 -
溶液中离子种类发生改变
H2SO4 + Na2CO3——
Na2SO4+ + H2O
H2SO4 + Ba(NO3)2 ——
BaSO4 ↓ + 2HNO3
NaOH + Ba(NO3) 2 ——
Ba(OH)2 + NaNO3
溶液中离子种类没有改变
二、复分解反应发生的条件
NaOH + HCl = NaCl + H2OAgNO3 + NaCl = AgCl + NaNO3CaCO3 + 2HCl =CaCl2 + H2O +CO2
KOH、NaOH、Ba(H)2、NH3·H2O,四碱溶,Ca(OH)2微溶,其余的全不溶。
钾盐、钠盐、铵盐、硝酸盐
盐酸盐(Cl-):除 不 溶,其余全溶;
硫酸盐(SO42-):除 不溶,硫酸钙、硫酸银微溶,其余全溶;
碳酸盐(CO32-):除碳酸钾、碳酸钠、碳酸铵溶,MgCO3微溶,其余不溶。
我最快:下列反应能不能发生?能发生的写出化学方程式,不能发生的说明理由。 1.BaCl2 + H2SO4 —— 2.Na2CO3 + CaCl2—— 3.K2SO4 + HCl—— 4.FeCl3 + NaOH—— 5.KCl + AgNO3 —— 6.K2SO4 + NaNO3——
例1、若不用其他试剂,如何鉴别FeCl3、NaOH、HCl 三种溶液。
三、复分解反应的应用:
FeCl3
1、若不用其他试剂,而用最简便的方法鉴别下列四种溶液:①MgSO4溶液 ②KOH溶液 ③CuSO4溶液 ④NaCl溶液。鉴别的正确顺序是( )A.③②①④ B.④③②① C.①②③④ D.③①④②
题型2. 除杂题 例1、除去下列物质所含杂质的方法中,正确的是 ( )
2、下列选用的除杂试剂和实验操作都正确的是(括号内为杂质) ( )A.NaCl溶液(Na2 CO3) 加足量稀硫酸B.CaCl2(Ca CO3) 加足量稀硝酸、蒸发、结晶C.Fe(Cu) 加足量稀盐酸、过滤、洗涤、干燥D.KOH溶液(K2CO3) 加适量氢氧化钡溶液、过滤
下列物质能否反应?为什么?
(1)CuSO4+Ba(NO3)2
(2)H2SO4+Ca(OH)2
(3)NaCl+KNO3
(4)K2CO3+HCl
(5)Fe(OH)3+HCl
(6)MgSO4+BaCO3
(7)Mg(OH)2+FeCl3
(8)ZnCO3+HCl
(9)CuSO4+Fe(OH)3
现有Mg、MgO、Mg(OH)2、H2SO4、CuSO4几种物质之间反应能得到MgSO4的组合一共有几个 ( )A、4个 B、5个C、6个 D、无法确定
例2、用一种试剂鉴别NaCl、HCl、BaCl2三种无色溶液。写出有关方程式。
2HCl + Na2CO3 == 2NaCl + H2O + CO2↑BaCl2 + Na2CO3 == BaCO3↓ + 2NaCl
10.微专题10 复分解反应的条件及物质的共存课件PPT: 这是一份10.微专题10 复分解反应的条件及物质的共存课件PPT,共11页。PPT课件主要包含了Fe2+,Cl-Ag+等内容,欢迎下载使用。
初中化学中考复习 2020年人教版中考化学专题复习课件:专题3 工艺流程专题3: 这是一份初中化学中考复习 2020年人教版中考化学专题复习课件:专题3 工艺流程专题3,共33页。PPT课件主要包含了类型1,提取银和金,或提炼贵金属等,碲元素损失,固体质量不再增加,类型2,将铜置换出来,Fe+H2SO4,减少了环境污染,玻璃棒等内容,欢迎下载使用。
化学3 海水“制碱”课文配套课件ppt: 这是一份化学3 海水“制碱”课文配套课件ppt,共18页。PPT课件主要包含了NaHCO3,小苏打,又称酸式碳酸钠,碳酸氢钠,Na2CO3,与酸碱指示剂作用,纯碱的性质,与酸反应,或碳酸氢根离子,与氯化钡的反应等内容,欢迎下载使用。













