






高中化学人教版 (2019)选择性必修1第一节 反应热试讲课ppt课件
展开【例1】在25 °C和101 kPa下,1 ml气态H2与1 ml 气态Cl2反应生成2 ml 气态HCl时放出184.6 kJ的热量,则该反应的热化学方程式为:
H2 (g) + Cl2 (g) = 2HCl(g) △H= -184.6 kJ/ml
【思考】我们已经知道了该如何表示化学反应中的物质变化,又知道了如何表示反应热。该怎样将这两者同时表示出来呢?
热化学方程式:能表明反应所释放或吸收的热量的化学方程式。
【思考】请根据上述例子尝试写出以下反应的热化学方程式。
(1)在25 0C和101 kPa下,1 ml气态H2与0.5ml气态O2反应生成1 ml 气态H2时,放出241.8 kJ的热量。(2)在25 0C和101 kPa下, 1ml气态H2与0.5ml气态O2反应生成1ml液态H2O时,放出285.8 kJ的热量。
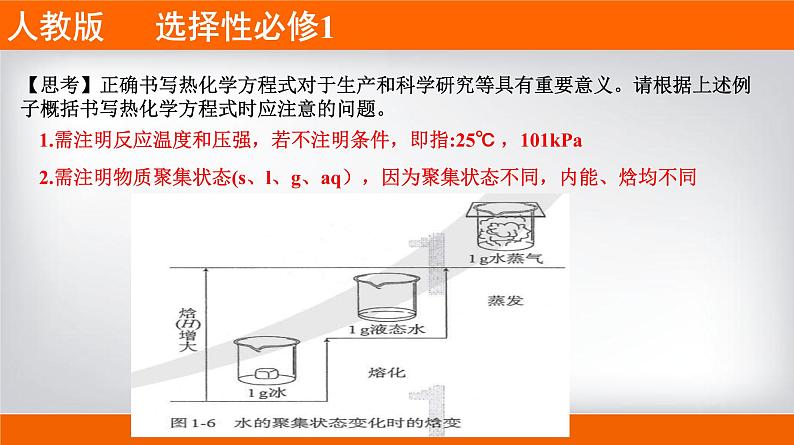
【思考】正确书写热化学方程式对于生产和科学研究等具有重要意义。请根据上述例子概括书写热化学方程式时应注意的问题。
1.需注明反应温度和压强,若不注明条件,即指:25℃ ,101kPa
2.需注明物质聚集状态(s、l、g、aq),因为聚集状态不同,内能、焓均不同
3.化学计量数只表示物质的量,可为整数,也可为分数
反应①的△H是反应②的两倍。因此,书写热化学方程式时,△H必须与化学方程式一一对应。
4.当反应逆向进行时,其反应热与正反应的ΔH 数值相等,符号相反
1.依据事实,写出下列反应的热化学方程式。 (1)1mlC(固态)与适量H2O(气态) 反应,生成CO(气态)和H2(气态),吸收131.3kJ的热量 (2)电解1mlH2O(液态)吸收285.8kJ的热量 (3)1mlCH4在氧气中燃烧放出890.3KJ热量
C(s)+H2O(g)=CO(g)+H2(g) ΔH = +131.3kJ/ml
留意:热化学方程式一般不需要写反应条件,不需标“↓”、“↑”
CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH= - 890.3 kJ/ml
2. 同温、同压下,比较Q1与Q2的大小: S(g)+O2(g) = SO2(g) ΔH1= - Q1 kJ/ml S(s)+O2(g) = SO2(g) ΔH2= - Q2 kJ/ml
再思考:若是比较ΔH1、ΔH2的大小呢?
3. 已知:H2(g)+Cl2(g)=2HCl(g) ΔH=-184.6kJ/ml 则反 应HCl(g)=1/2H2(g)+1/2Cl2(g)的ΔH为 A. +184.6 kJ/ml B. -92.3 kJ/ml C. -369.2 kJ/ml D. +92.3 kJ/ml
4.已知金属钠在氯气中燃烧生成1ml NaCl时,放出 411KJ热量,下列热化学方程式正确的是 A.2Na(s)+Cl2(g)=2NaCl(s) ΔH=-411kJ/ml B.2Na(s)+Cl2(g)=2NaCl(s) ΔH=+822kJ/ml C.Na(s)+1/2Cl2(g)=NaCl(s) ΔH=-411kJ/ml D.Na(s)+1/2Cl2(s)=NaCl(s) ΔH=-411kJ/ml
5. 下图表示合成氨的能量变化情况,下列热化学方程式 正确的是 A. N2(g)+3H2(g)=2NH3(g) ΔH=(a-b)kJ/ml B. 1/2N2(g)+3/2H2(g)=NH3(g) ΔH=(b-a)kJ/ml C. N2(g)+3H2(g)=2NH3(l) ΔH=2(a-b-c)kJ/ml D. 1/2N2(g)+3/2H2(g)=NH3(l) ΔH=(a-b)kJ/ml
通过上述例子,可知道由于反应的情况不同,反应热可分为多种。其中,与燃料品质相关的燃烧热在实际中应用较广。
燃烧热:在101kPa时,1ml纯物质完全燃烧生成指定产物时所放出的热量,叫做该物质的燃烧热,单位是kJ/ml。
2.指定产物:指可燃物中的碳元素变为CO2(g),氢元素变为H2O(1),硫元素变为SO2(g),氮元素变为N2(g)等。
1.在表示燃烧热的热化学方程式里可燃物的化学计量数为1。
例:燃烧热通常利用量热计由实验测得。例如,实验测得在250C和101 kPa时,1 ml H2完全燃烧生成液态水,放出285.8 kJ的热量,这就是H2的燃烧热。
【思考】在250C和101 kPa时,某些物质的燃烧热如图。煤、石油、天然气是当今世界重要的化石燃料。煤的主要成分是碳单质(C),,天然气的主要成分是甲烷(CH4),请写出它们燃烧的热化学方程式。
【思考】在250C和101 kPa时,某些物质的燃烧热如图。煤、石油、天然气是当今世界重要的化石燃料。煤的主要成分是碳单质(C),天然气的主要成分是甲烷(CH4),请写出它们燃烧的热化学方程式。
2. 下列热化学方程式中△H代表燃烧热的是A . CH4(g)+3/2O2 (g)=2H2O(l)+CO(g) △H1B . S(g)+3/2O2(g)=SO3(s) △H2C . C6H12O6(s)+6O2(g)=6CO2(g)+6H2O(l) △H3D . 2CO(g)+O2(g)= 2CO2(g) △H4
1. 下列各组物质的燃烧热相等的是:( )A.炭和一氧化碳 B.1ml炭和2ml炭C.1ml乙炔和2ml炭 D.淀粉和纤维素
3. 在 101 kPa时,1.6克 CH4 完全燃烧生成CO2和液态水放出 89.03 kJ的热量,写出表示CH4燃烧热的热化学方程式。
CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H= - 890.3 kJ/ml
4. 已知:2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ/ml H2(g)+1/2O2(g)=H2O(g) ΔH=-241.8 kJ/ml,求氢气的燃烧热。
氢气的燃烧热ΔH=-285.8 kJ/ml
【研究与实践】 了解火箭推进剂[研究目的]火箭推进剂在航天和军事等领域具有广泛的应用。通过查阅资料,了解火箭推进剂的发展历史、现状及趋势,感受火箭推进剂的发展对人类社会进步的促进作用,体会化学反应中能量变化的重要价值。[研究任务](1)了解火箭推进剂的发展历史。(2)了解我国目前常用的火箭推进剂的类型、成分和特点。(3)了解火箭推进剂的发展趋势。[结果与讨论](1)通过研究,你得到什么启示?(2)撰写研究报告,并与同学讨论。
长征火箭的第三级使用的推进剂是
N2H4(肼)和NO2
2011年11月1日5时58分10秒
【学习评价三】教材P12
5.氢能是一种理想的绿色能源。有科学家预言,氢能有可能成为人类未来的主要能源。(1)为什么说氢能是一种理想的绿色能源?(2)请根据本书后附录I所提供的燃烧热数据,计算相同质量的氢气、甲烷、乙醇在25 0C和101 kPa时完全燃烧放出的热量,据此说明氢气作为能源的优点。(3)查阅资料,了解氢能在利用过程中需要解决的技术难题,以及氢能利用的发展前景。
人教版 (2019)选择性必修1第一章 化学反应的热效应第一节 反应热教案配套ppt课件: 这是一份人教版 (2019)选择性必修1第一章 化学反应的热效应第一节 反应热教案配套ppt课件,共27页。PPT课件主要包含了学习目标,课前导入,只表示物质变化,热化学方程式,化学方程式,知识点一,书写步骤,①写方程式,②标状态,③标条件等内容,欢迎下载使用。
人教版 (2019)选择性必修1第一节 反应热评课课件ppt: 这是一份人教版 (2019)选择性必修1第一节 反应热评课课件ppt,共1页。
高中化学人教版 (2019)选择性必修1第一节 反应热优质ppt课件: 这是一份高中化学人教版 (2019)选择性必修1第一节 反应热优质ppt课件,共31页。PPT课件主要包含了情境导入,铝热反应,物质变化,你知道吗,资料卡,阅读教材P9,应用探究等内容,欢迎下载使用。













