

四川省宜宾市第四中学2019-2020学年高一下学期第四学月考试化学试题
展开2020年春四川省宜宾市第四中学高一第四学月考试
化学试题
注意事项:1.答题前,考生先将自己的姓名、准考证号码填写清楚,将条形码准确粘贴在条形码区域内。2.答题时请按要求用笔。 3.请按照题号顺序在答题卡各题目的答题区域内作答,超出答题区域书写的答案无效;在草稿纸、试卷上答题无效。4.作图可先使用铅笔画出,确定后必须用黑色字迹的签字笔描黑。5.保持卡面清洁,不要折叠、不要弄破、弄皱,不准使用涂改液、修正带、刮纸刀。
6.考试时间:150分钟;物理化学生物同堂分卷考试,物理100分,化学100分,生物100分,共300分
7.可能用到的相对原子质量:H 1 C 12 N 14 O 16 Mg 23 P 31 S 32 Fe 56 Cu 64
第I卷 选择题(50分)
一、单选题(每小题5分,共10个小题,共50分)
1.下列物质中,可形成酸雨的是
A.二氧化硫 B.氟氯代烃 C.二氧化碳 D.甲烷
2.下列关于浓硫酸的叙述正确的是
A. 浓硫酸具有吸水性,因而能使蔗糖炭化
B. 浓硫酸在常温下可迅速与铜片反应放出二氧化硫气体
C. 浓硫酸是一种干燥剂,能够干燥氨气、氢气等气体
D. 浓硫酸在常温下能够使铁、铝等金属钝化
3.针对实验室制取氨气,下列说法不正确的是
A.发生装置与用KClO3制取O2的装置相同
B.可用排饱和氯化铵溶液的方法收集氨气
C.氨气的验满可以用湿润的红色石蕊试纸或蘸有浓盐酸的玻璃棒放于试管口附近
D.所用的铵盐不是NH4NO3,是因为NH4NO3受热易爆炸
4.mg铜与足量的浓H2SO4共热时完全反应,在标准状况下生成nL气体,则被还原的浓硫酸是
A.g B.2×mol C.mol D.g
5.有X、Y两种主族元素,原子序数小于等于20,X的原子半径小于Y,且X、Y原子的最外层电子数相同(选项中m、n均为正整数)。下列说法中正确的是
A.若X(OH)n为强碱,则Y(OH)n也一定为强碱
B.若HnXOm为强酸,则X的氢化物溶于水一定显酸性
C.若X元素形成的单质是X2,则Y元素形成的单质一定是Y2
D.若Y的最高正价为m,则X的最高正价一定为m
6.下列化学用语中,正确的是
A. 次氯酸的结构式:H—O—Cl B. 氮气的电子式:∶N∶∶∶N∶
C. CO2分子的球棍模型:
D. 用电子式表示氯化氢分子的形成过程:
7.下列离子方程式书写正确的是
A. 向Fe2(SO4)3溶液中加入过量铁粉:Fe3++Fe=2Fe2+
B. 过量二氧化硫通入澄清石灰水中:SO2+Ca2++2OH-=CaSO3↓+H2O
C. 向水玻璃中滴加盐酸:Na2SiO3 + 2 H+=H2SiO3 ↓+ 2Na+
D. 向Fe(NO3)2稀溶液中加入盐酸:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O
8.将25.6gCu完全溶于适量浓硝酸中,收集到氮的氧化物(含NO、N2O4、NO2)的混合物共0.4mol,这些气体恰好能被500mL 1mol/LNaOH溶液完全吸收,生成含NaNO3和NaNO2的盐溶液,其中NaNO3的物质的量为
A. 0.2mol B. 0.1mol C. 0.4mol D. 0.3mol
9.在NO2被水吸收的反应中,发生还原反应和氧化反应的物质的质量比为
A. 3∶1 B. 1∶3 C. 1∶2 D. 2∶1
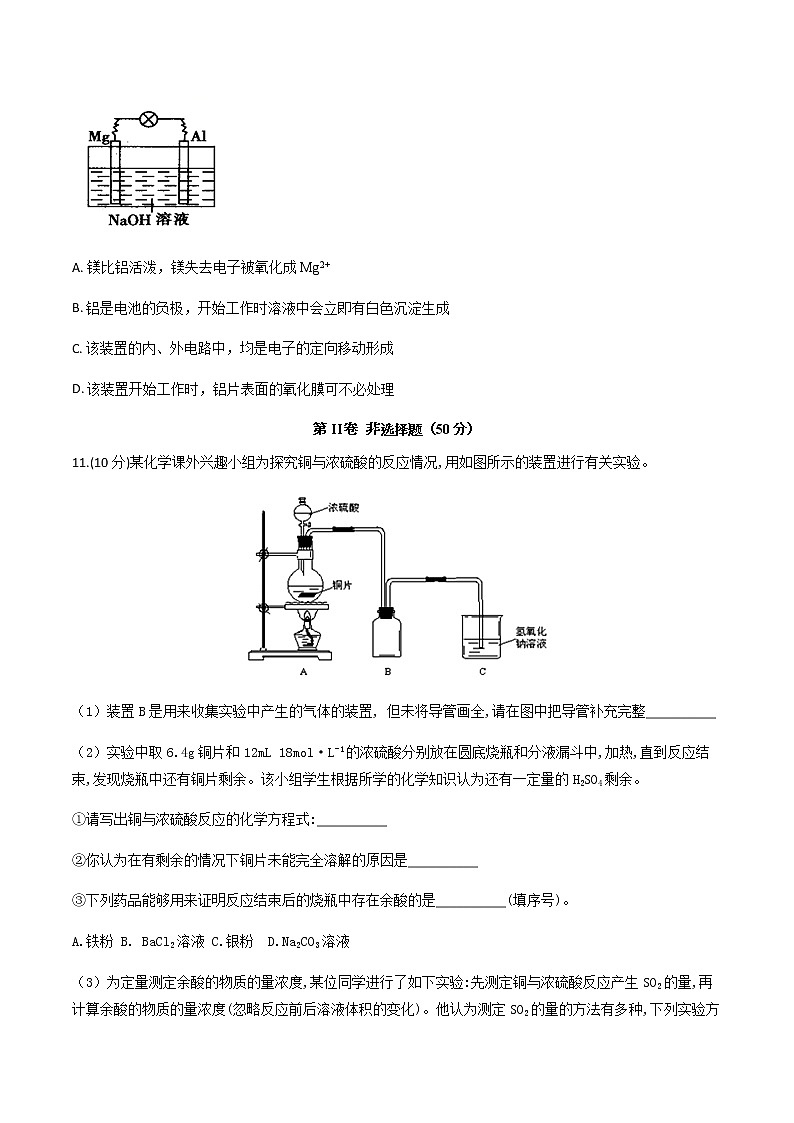
10.如图所示,将镁片、铝片平行插入一定浓度的NaOH溶液中,用导线连成闭合回路,该装置在工作时,下列叙述中正确的是
A. 镁比铝活泼,镁失去电子被氧化成Mg2+
B. 铝是电池的负极,开始工作时溶液中会立即有白色沉淀生成
C. 该装置的内、外电路中,均是电子的定向移动形成
D. 该装置开始工作时,铝片表面的氧化膜可不必处理
第II卷 非选择题(50分)
11.(10分)某化学课外兴趣小组为探究铜与浓硫酸的反应情况,用如图所示的装置进行有关实验。
(1)装置B是用来收集实验中产生的气体的装置, 但未将导管画全,请在图中把导管补充完整__________
(2)实验中取6.4g铜片和12mL 18mol·L-1的浓硫酸分别放在圆底烧瓶和分液漏斗中,加热,直到反应结束,发现烧瓶中还有铜片剩余。该小组学生根据所学的化学知识认为还有一定量的H2SO4剩余。
①请写出铜与浓硫酸反应的化学方程式:__________
②你认为在有剩余的情况下铜片未能完全溶解的原因是__________
③下列药品能够用来证明反应结束后的烧瓶中存在余酸的是__________(填序号)。
A.铁粉 B. BaCl2溶液 C.银粉 D.Na2CO3溶液
(3)为定量测定余酸的物质的量浓度,某位同学进行了如下实验:先测定铜与浓硫酸反应产生SO2的量,再计算余酸的物质的量浓度(忽略反应前后溶液体积的变化)。他认为测定SO2的量的方法有多种,下列实验方案中可行的是__________(填序号,下同),最终计算得出的余酸的物质的量浓度比实际偏高的是__________
A.将装置A产生的气体缓缓通过预先称量过的盛有碱石灰的干燥管,反应结束后再次称量干燥管
B.用排水法测定装置A产生气体的体积
C.将装置A产生的气体缓缓通入足量稀硝酸酸化的硝酸钡溶液中,反应完全后,过滤、洗涤、干燥、称量沉淀
12.(10分)已知X、Y均为有刺激性气味的气体,且几种物质间有以下转化关系,部分产物未标出。
回答下列问题:
(1)写出下列各物质的化学式:X____、Y_____、A_____、B_____、C____。
(2)反应①的的化学方程式为_____,反应②的离子方程式为____。
13.(10分)①~⑦在元素周期表的对应位置如图所示,回答下列问题。
周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 |
|
|
| ⑦ | ① | ② |
|
|
3 | ③ | ④ | ⑤ |
|
|
| ⑥ |
|
(1)元素⑥的原子结构示意图___________;元素的最高正价①___________②(填>、<、=)
(2)向元素⑤和⑥形成的化合物的水溶液中加入过量的①的氢化物的水溶液,反应的离子方程式是______________
(3)元素③的最高价氧化物对应的水化物为_______(填离子化合物或共价化合物)
(4)元素②和③形成的一种化合物为淡黄色固体,该化合物的电子式为______,该化合物中化键有_______(填离子键、极性键或非极性键),该化合物与⑦的最高价氧化物反应的化学方程式为_____。
14.(10分)中学化学中的一些常见物质有如图转化关系。其中A、H为空气中的主要成分,气体B能使湿润的红色石蕊试纸变蓝,气体D遇到A很快变成红棕色E,C是黑色金属氧化物,I是紫红色金属单质。X为常见液体(部分反应条件及生成物没有全部列出)。
回答下列问题:
(1)B的化学式为________ C的化学式为___________D的化学式为___________
(2)B的实验室制法的化学方程式____________________
(3)写出反应①的化学方程式_______________________。
(4)写出反应②的离子方程式_______________________。
15.(10分)有甲、乙、丙、丁、戊五种短周期元素,原子序数依次增大,其常见化合价依次为+1、-2、+1、+3、-1。它们形成的物质间的转化关系如下图所示。常温下用惰性电极电解(有阳离子交换膜)1L l mol/L的A溶液。
请按要求回答下列问题:
(1)己元素与丙元素同主族,比丙原子多2个电子层,则己的原予序数为______;推测相同条件下丙、己单质分别与水反应剧烈程度的依据是_________。
(2)甲、乙、戊按原予个数比1:1:1形成的化合物Y具有漂白性,其电子式为______。
(3)上图转化关系中不属于氧化还原反应的有(填编号)______。
(4)接通如图电路片刻后,向烧杯中滴加一种试剂即可检验铁电极被腐蚀,此反应的离子方程式为___________。
(5)写出反应③的化学方程式_________;反应②的离子方程式为___________。
(6)若上图中各步反应均为恰好完全转化,则混合物X中含有的物质(除水外)有___________。
2020年春四川省宜宾市第四中学高一第四学月考试
化学试题答案
1.A 2.D 3.B 4.D 5.A 6.A 7.D 8.B 9.C 10.D
11. Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O 随着H2SO4的消耗,浓硫酸的浓度不断降低,稀硫酸与Cu不反应 AD C B
12.Cl2 SO2 HCl H2SO4 FeCl3 Cl2+SO2+2H2O=2HCl+H2SO4 2Fe3++SO2+2H2O=2Fe2++SO42-+4H+ 13. > Al3++3NH3·H2O=Al(OH)3↓+3NH4+ 离子化合物 离子键、非极性共价键 2Na2O2+CO2=2Na2CO3+O2
14.NH3 CuO NO 2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O 4NH3+5O24NO+6H2O 3Cu+8H++2NO3—=3Cu2++NO↑+4H2O
15.37 同主族元素的金属性随核电荷数的增加而增强,推测己单质与水反应较丙更剧烈 ④ 3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓ Cl2 + H22HCl 2A1+2OH-+2H2O=2AlO2-+3H2↑ Al(OH)3、NaCl








