












所属成套资源:人教版高中化学同步选择性必修第一册课件PPT+讲义+专练(新教材)
- 第二章 第二节 第6课时 化学反应速率与平衡图像(1)--人教版高中化学选择性必修第一册同步课件+讲义+专练(新教材) 课件 0 次下载
- 第二章 第二节 第7课时 化学反应速率与平衡图像(2)--人教版高中化学选择性必修第一册同步课件+讲义+专练(新教材) 课件 0 次下载
- 第二章 第四节 化学反应的调控--人教版高中化学选择性必修第一册同步课件+讲义+专练(新教材) 课件 0 次下载
- 第二章 第四节 实验活动1 探究影响化学平衡移动的因素--人教版高中化学选择性必修第一册同步讲练测(新教材) 试卷 0 次下载
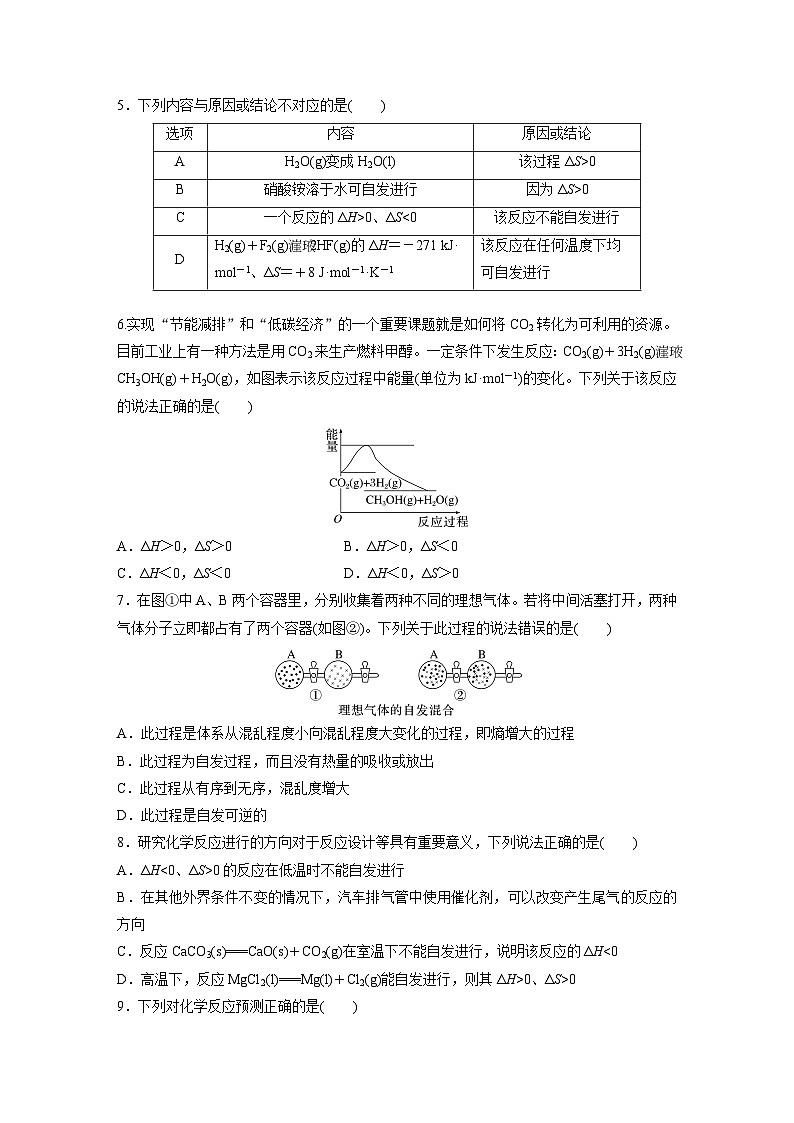
- 第二章 体系构建 高考体验--人教版高中化学选择性必修第一册同步课件+讲义+专练(新教材) 课件 0 次下载
人教版 (2019)选择性必修1第三节 化学反应的方向完美版ppt课件
展开
这是一份人教版 (2019)选择性必修1第三节 化学反应的方向完美版ppt课件,文件包含第二章第三节化学反应的方向pptx、第二章第三节化学反应的方向专练docx、第二章第三节化学反应的方向教师版docx、第二章第三节化学反应的方向学习笔记docx等4份课件配套教学资源,其中PPT共60页, 欢迎下载使用。
第三节 化学反应的方向
1.知道化学反应是有方向的,通过宏观事实推理、建构化学反应的方向与反应 的焓变和熵变的关系的认知模型。2.能结合具体事例说明反应自发进行的方向性。
核心素养 发展目标
一、自发过程与自发反应
二、化学反应进行方向的判据
1.自发过程(1)含义:在一定条件下,不用借助外力就可以自发进行的过程。例如高山流水、自由落体。(2)特点①体系趋向于从 状态转变为 状态(体系对外部做功或释放热量)。②在密闭条件下,体系有从 自发转变为 的倾向(无序体系更加稳定)。(3)非自发过程:在一定条件下,需持续借助外力才能进行的过程。
2.自发反应(1)含义:在给定的条件下,无需外界帮助,一经引发即能自动进行的反应,称为自发反应。例如钢铁生锈。(2)非自发反应:不能自发进行,必须借助某种外力才能进行的反应。3.应用(1)自发反应可被用来做“有用功”。例如H2的燃烧可设计成燃料电池。(2)非自发过程要想发生,必须对它做功。例如通电将水分解为H2和O2。
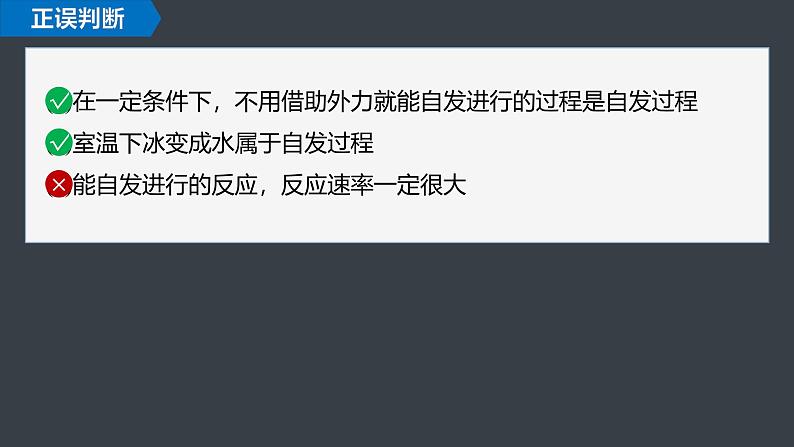
(1)在一定条件下,不用借助外力就能自发进行的过程是自发过程(2)室温下冰变成水属于自发过程(3)能自发进行的反应,反应速率一定很大
(1)自发反应不需要任何条件就能发生吗?
提示 自发反应也需要一定条件引发反应,一旦反应后即可自发进行。
(2)非自发反应一定不能发生吗?
提示 非自发反应在一定条件下能发生。
2.知道了某个反应是自发反应后,能否知道某条件下是否发生?能否预测反应的快慢?
提示 判断某反应是否自发,只是判断反应的方向,与是否会发生、反应的快慢无关。
1.下列关于自发反应的叙述正确的是A.自发反应的逆过程在相同条件下也必定是自发的B.铁在潮湿的空气中生锈属于非自发反应C.自发过程可以是物理过程,不一定是自发反应,而自发反应一定是 自发过程D.自发反应与外界条件无关
2.过程自发性的作用是A.判断过程的方向B.确定过程是否一定会发生C.判断过程发生的速率D.判断过程的热效应
化学反应进行方向的判据
1.焓变与化学反应的方向(1)放热反应过程中体系能量 ,因此具有 进行的倾向,科学家提出用焓变(能量变化)来判断反应进行的方向,这就是焓判据(能量判据)。(2)焓变与化学反应进行方向的关系①大多数放热反应是可以自发进行的。例如燃烧反应、中和反应等。②有些吸热反应也可以自发进行,如:2N2O5(g)===4NO2(g)+O2(g) ΔH=+109.8 kJ·ml-1。(3)结论:反应的焓变是制约化学反应能否自发进行的因素之一,但不是唯一因素。
2.熵变与化学反应的方向(1)熵、熵变的概念
(2)熵值大小①体系的熵值:体系的 越大,体系的熵值就 。②物质的熵值:同一种物质的熵值S(g) S(l) S(s),且物质的量越大,熵值越大,同一条件下,不同物质的熵值不同。③反应前后熵值变化:虽然不同物质熵值不同,但气体物质的熵值最大,一般情况下,可以根据反应前后气体物质的量的变化大体判断熵值增大或减小。
(3)熵判据体系有自发地向混乱度 (即 )的方向转变的倾向,因此可用熵变来判断反应进行的方向。(4)熵变与化学反应进行方向的关系①许多熵增的反应是自发的(多是气体分子数目增多的反应),如:Zn(s)+H2SO4(aq)===ZnSO4(aq)+H2(g);2KClO3(s)===2KCl(s)+3O2(g)。
②有些熵减的反应也可以自发进行,如:2NO(g)+2CO(g)===N2(g)+2CO2(g);4Fe(OH)2(s)+O2(g)+2H2O(l)===4Fe(OH)3(s)。(5)结论:熵变是影响反应自发进行的因素之一,但不是唯一因素。
3.自由能与化学反应的方向(1)自由能ΔG= 。ΔG不仅与焓变和熵变有关,还与温度有关。ΔG单位:kJ·ml-1。T:开尔文温度,单位K。(2)反应方向与自由能的关系化学反应总是向着 的方向进行,直到体系 。①当ΔG<0时,反应 自发进行;②当ΔG=0时,反应处于 ;③当ΔG>0时,反应 自发进行。
(1)放热反应一定能自发进行(2)O2转化变为O3时,熵减小(3)熵增的反应一定能自发进行(4)合成氨反应:N2(g)+3H2(g) 2NH3(g) ΔH0
9.下列对化学反应预测正确的是
10.灰锡结构松散,不能用于制造器皿,而白锡结构坚固,可以制造器皿。现把白锡制成的器皿放在0 ℃、100 kPa的室内存放,它会不会变成灰锡而不能再继续使用(已知:在0 ℃、100 kPa条件下白锡转化为灰锡的反应焓变和熵变分别为ΔH=-2 180.9 J·ml-1,ΔS=-6.61 J·ml-1·K-1)A.会变成灰锡B.不会变成灰锡C.不能确定D.升高温度才会变成灰锡
11.反应:CH3OH(l)+NH3(g)===CH3NH2(g)+H2O(g)在某温度下才能自发向右进行,若反应的|ΔH|=17 kJ·ml-1,该温度下|ΔH-TΔS|=17 kJ·ml-1,则下列选项正确的是A.ΔH>0,ΔH-TΔS
相关课件
这是一份化学人教版 (2019)第二节 化学平衡完整版课件ppt,文件包含第二章第二节第2课时化学平衡常数pptx、第二章第二节第2课时化学平衡常数专练docx、第二章第二节第2课时化学平衡常数教师版docx、第二章第二节第2课时化学平衡常数学习笔记docx等4份课件配套教学资源,其中PPT共60页, 欢迎下载使用。
这是一份高中化学人教版 (2019)选择性必修1第二节 化学平衡优质课件ppt,文件包含第二章第二节第1课时化学平衡状态pptx、第二章第二节第1课时化学平衡状态专练docx、第二章第二节第1课时化学平衡状态教师版docx、第二章第二节第1课时化学平衡状态学习笔记docx等4份课件配套教学资源,其中PPT共60页, 欢迎下载使用。
这是一份高中化学人教版 (2019)必修 第一册第二章 海水中的重要元素——钠和氯实验活动1 配制一定物质的量浓度的溶液优质ppt课件,文件包含第二章第三节第4课时配制一定物质的量浓度的溶液pptx、第二章第三节第4课时配制一定物质的量浓度的溶液专练docx、第二章第三节第4课时配制一定物质的量浓度的溶液教师版docx、第二章第三节第4课时配制一定物质的量浓度的溶液学生版docx、配置一定物质的量浓度的溶液mp4等5份课件配套教学资源,其中PPT共60页, 欢迎下载使用。










