









高中化学第三节 化学反应的方向评课课件ppt
展开《化学反应的方向》教学设计
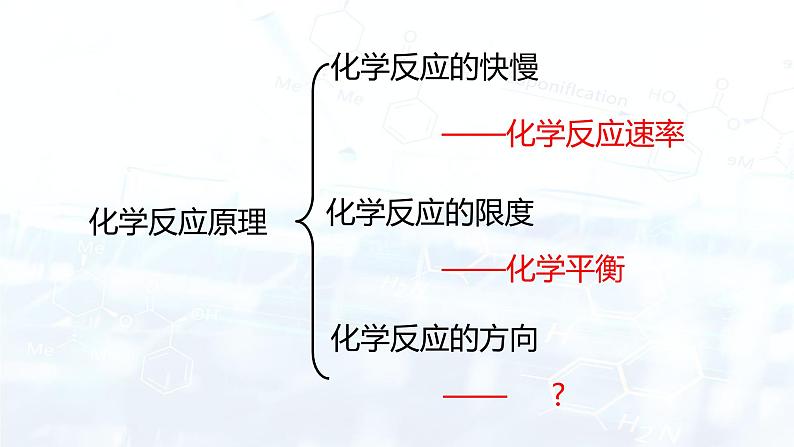
一、课标解读
《化学反应原理》中主题2化学反应的方向、限度和速率,2.3 化学反应的方向
1.内容要求
知道化学反应是有方向的,知道化学反应的方向与反应的焓变和熵变有关。
二、教材分析
在人教版新教材中,精简了文字表述的内容,主旨内容更加突出,重点介绍了焓变、熵变与化学反应进行方向的关系。旧版教材中,还强调了根据反应的焓判据和熵判据,只能判断反应自发进行的可能性,不能决定反应是否一定发生或反应速率的大小。新版教材中删去了这部分的内容,知识难度降低,同时减少了对“熵”的概念的解释,只要求学生知道“熵”与体系的“混乱度”有关。
教材力图从学生熟悉的化学反应出发,介绍化学反应有向能量降低的方向自发进行的倾向,体会能量最低原理在化学过程中的存在;通过气体扩散和晶体溶解两个实例引出反应的自发性还与体系的混乱度(熵)有关,说明混乱度(熵)增加是自然界的普遍规律,也是化学反应自发进行的一种倾向。发展学生“变化观念和平衡思想” 的素养。为了加深学生对化学反应进行方向的认识,用实例说明单独运用上述判据中的任一种,都可能出现错误,都不是全面的。要正确的判断化学反应的方向,需要综合考虑焓变和熵变的复合判据。诱导学生得出:事物的发展、变化常常受多种因素的制约,发展学生“证据推理和模型认知”的素养。在练习与应用中,增加了自发过程中焓变、熵变判断的习题。
三、学情分析
学生已经学习了化学反应速率、化学平衡,具备了一些化学反应原理的知识。自发过程和熵变的概念比较抽象,在教学过程中应充分结合生活情景和已有化学知识,加以引导,学生就能够理解、掌握该节相关知识。
四、素养目标
【教学目标】
1.能通过教师列举的例子知道化学反应的进行是有方向的;
2.了解熵变的概念,能初步判断体系变化过程中的熵变;
3.能用根据化学反应的焓变和熵变判断化学反应进行的方向。
【评价目标】
1.通过学生对自发反应的举例,诊断学生对化学反应进行的方向的了解;
2.通过对比分析不同自发反应中焓变和熵变的情况,诊断并发展学生的辩证思维;
3.通过引入科学家研究化学反应进行方向的化学史,发展学生“科学精神与社会责任”的素养。
五、教学重点、难点
(1)重点:化学反应的方向与反应的焓变、熵变的关系。
(2)难点:化学反应的方向与反应的焓变、熵变的关系。
六、教学方法
讲授法、问题推进法
七、教学思路
落实目标 | 任务 | 问题线 | 设计意图 |
教学目标1 | 任务1:自发过程 | 二氧化碳为什么难以分解成碳和氧气? | 从较新奇的角度对常见化学反应提出一个疑问,引起学生思考,激发学生的探究兴趣 |
教学目标1 | 什么是自发反应? | 通过类比迁移自然界、生活中的自发变化,学习自发反应的定义。 | |
教学目标3 | 任务2:焓判据 | 如何判断自发反应? | 类比迁移自然界、生活中的自发过程的能量变化特点,引导学生从能量的角度做出判断,了解放热反应的自发性 |
吸热反应一定不能发生吗? | 引导学生思考能自发进行的吸热反应,根据反例认识到焓判据的局限性。 | ||
教学目标2 | 任务3:熵判据 | 吸热反应为什么能自发进行? | 由自然界、生活中自发过程的共同特点入手,引导学生从混乱度的角度做出判断,认识到化学反应趋向于向熵增的方向进行。 |
熵减反应一定不能发生吗? | 通过举出具体实例说明熵判据也不是唯一因素从而去寻求更合理的判断依据。 | ||
教学目标3 | 任务4:复合判据 | 利用焓变、熵变对反应方向的判断不一致时怎么办? | 从学生比较熟悉的四个反应入手,通过运用焓判据和熵判据时存在的矛盾,激发学生寻求更为合适的判据的探究意识。 |
八、教学过程
环节 | 教师活动 | 学生活动 | |||||||||||||||
导入情境 | 【提出问题】碳可以与氧气燃烧生成二氧化碳,二氧化碳却不能分解成碳和氧气,为什么? [引入]上述问题是化学反应的方向问题。反应进行的快慢、限度和方向是化学反应原理的三个重要组成部分。通过前三节的学习和讨论,我们已经初步解决了前两个问题,即反应的快慢和限度问题,这节课我们来讨论反应的方向的问题。 [板书]第三节 化学反应进行的方向
|
| |||||||||||||||
任务1:自发反应 | 【展示图片】水由高处流向低处、红墨水扩散、花香四溢、铁生锈 【启发】自然界中有许多变化是有明显的方向性的,比如:水会从高处往低处流,红墨水滴入水中会扩散,花香会扩散四溢,铁在潮湿空气中会生锈。这些变化反过来却不能发生。 【讲述】我们把这些在一定条件下,不需借助外力就能自动进行的过程,叫自发过程。那么自发反应也就是在一定条件下,无需外界帮助就能自动进行的反应。
|
【想一想】能自发进行的化学反应有哪些?在学案上写出。 | |||||||||||||||
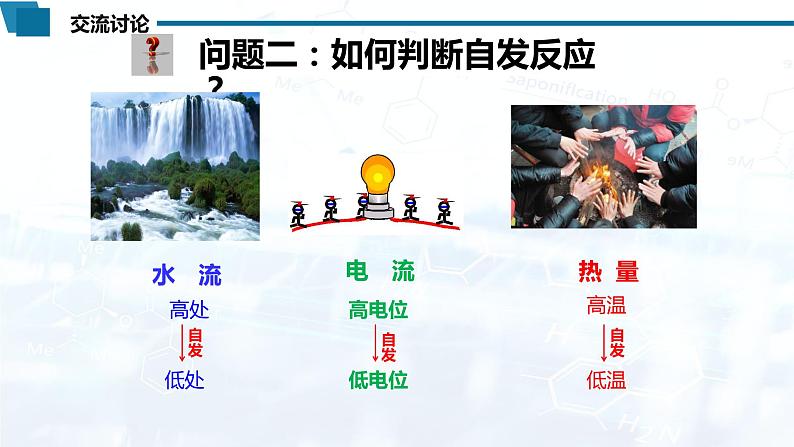
任务2:焓判据 | 【提问】如何判断一个反应能否自发进行? 【展示】水由高处流向低处,电流由高电位流向低电位,热量由高温传向低温
【引导】自然界中体系总是趋向于由不稳定的高能量状态转化为较稳定的低能量状态,在化学反应中,也有着与上述自发过程类似的能量变化。 【讲述】在放热反应中,由于反应物总能量高于生成物总能量,反应过程中体系能量降低,因此反应放热有利于反应自发进行。这条经验规律也就是判断化学反应方向的 “焓判据”。这是19世纪初,贝特罗和汤姆逊提出的。通过对热化学的研究,他们提出了吸热和放热的概念,并用量热计测量了一些化学反应的热效应,提出“放热反应可以自发进行,而吸热反应则不能自发进行”。 你同意贝特罗和汤姆逊的观点吗?
【展示】 2NH4Cl(s) + Ba(OH)2·8 H2O(s) = NH3(g) + BaCl2(s) + 10H2O(l) 2N2O5(g)=4NO2(g)+O2 (g) (NH4) 2CO3(s) = NH4HCO3(s)+NH3(g) 上述反应∆ H ﹥ 0 【讲述】多数自发进行的化学反应是放热反应,但是也有少数吸热反应能自发进行。因此反应是否放热只是反应能否自发进行的其中一个因素,不是唯一因素。不能只根据反应放热还是吸热来判断化学反应的方向。 |
【思考】自然界的自发过程有什么共同点? 能量高到能量低
【思考】吸热反应都不能自发进行吗? 一般能想到NH4Cl和Ba(OH)2·8 H2O的吸热反应。 | |||||||||||||||
任务3:熵判据 | 【提问】吸热反应为什么能自发进行? 【引导】有序排列的火柴从火柴盒散落变成无序排列,放在包里的耳机线总是会缠绕打结,整理干净的房间总是会变乱,两个纯物质接触后总是会自发混合。 化学反应能否自发进行还与什么因素有关? 【讲述】对,也就是说由“有序”变“无序”。 生活中司空见惯的小事总会给科学家以灵感和启发!1850年克劳修斯首次提出熵(entropy)这一物理量。用来描述体系的混乱的程度。体系越混乱,熵越大。在与外界隔离的体系中,反应自发地向熵增大(即熵变 ΔS >0)的方向进行。这是判断化学反应进行方向的熵判据。 【提问】根据熵的定义,同一物质不同状态下熵值相等吗? 【总结】同一物质,固态时熵值最小,气态时熵值最大。
【提问】下列吸热反应有什么共同点?为什么能自发进行? 2NH4Cl(s) + Ba(OH)2·8 H2O(s) = NH3(g) + BaCl2(s) + 10H2O(l) 2N2O5(g)=4NO2(g)+O2 (g) (NH4) 2CO3(s) = NH4HCO3(s)+NH3(g) 【总结】通常情况下,产生气体的反应,气体的分子数增大的反应,熵变都为正值,为熵增的反应,因此反应能自发进行。 【提问】自发反应一定是熵增的反应吗?
【结论】自发反应的方向与焓变、熵变有关,放热、熵增有利于反应自发进行。判断反应自发进行的方向,需综合考虑体系的焓变和熵变。
【练一练】 判断下列反应能否自发进行 2KClO3(s)==2KCl(s)+3O2(g) ∆ H = -78.03 kJ·mol-1 ∆ S = +494.4 J·mol-1·K-1; CO(g) = C(s,石墨) + 1/2O2(g) ∆ H =+110.5 kJ·mol-1 ∆ S = -89.36 J·mol-1·K-1; 4Fe(OH)2(s)+2H2O(l)+O2(g)==4Fe(OH)3(s) ∆ H = -444.3kJ·mol-1 ∆ S = -280.1 J·mol-1·K-1; CaCO3(s)= CaO(s)+ CO2(g) ∆ H = + 178.2 kJ·mol-1 ∆ S = +169.6 J·mol-1·K-1。
【提问】焓减并熵增的反应一定是自发的,相反焓增并熵减得反应一定是非自发的,那么如果熵变和焓变对自发反应方向性的判断不一致时,怎么办? |
【思考】上述自发过程的共同特点是什么? 答:体系混乱度增大。
【思考并回答】 冰中水分子是有序排列的,气态时水分子做无规则运动,因此固态时水的熵值最小,气态时最大。
【完成练习】 1.在下列变化中,体系的熵将发生怎样的变化? A.少量的食盐溶解于水中 B.气态水变成液态水 C. 2Na2SO3(s)+O2(g)===2Na2SO4(s) D.CaCO3(s)受热分解为CaO(s)和CO2(g) E. HCl(g) + NH3(g) = NH4Cl (s) 2.下列反应中,熵显著增加的反应是( ) A.CO(g)+2H2(g)===CH3OH(g) B.3NO2(g)+H2O(l)===2HNO3(aq)+NO(g) C.2C(s)+O2(g) === 2CO (g) D.2Hg(l)+O2(g)===2HgO(s)
【答】生成气体或气体分子数增大
【思考】哪些自发反应不是熵增的反应? 2H2(g) + O2(g) = 2H2O(l) ∆ S﹤0 【答】熵增有利于反应自发进行,但自发反应不一定是熵增的反应。
| |||||||||||||||
任务4:复合判据 | 【讲解】为了同时考虑能量和混乱度两方面的因素,1876年美国化学家Gibbs提出用自由能变化ΔG作为化学反应方向的判据。吉布斯认为化学反应总是向着自由能减小的方向进行,直至达到平衡。我们称之为复合判据。 在恒温、恒容的封闭体系中, ∆ G = ∆ H – T ∆ S (T=t+273.15) 【练一练】
|
思考并完成表格 | |||||||||||||||
【课堂小结】科学家们如果需要设计一个化学反应应用于科学研究或工业生产,需要知道在给定条件下该反应能否自发进行。在一定条件下,不借助外部力量就能自动进行的反应称为自发反应。从焓变的角度来看,反应放热有利于反应自发进行;从熵变的角度来看,熵增有利于反应自发进行。这两种判断方法都有局限性,要准确判断一个反应能否自发进行,需要综合考虑焓变和熵变,根据吉布斯自由能变来判断。 |
|
九、板书设计
焓判据
化学反应的方向 熵判踞
复合判据
十、课堂练习(典型性、代表性和覆盖面)
1.下列说法中正确的是( )
A.凡是放热反应都是自发的,吸热反应都是非自发的
B.自发反应一定是熵增大,非自发反应一定是熵减小或不变
C.熵增加且放热的反应一定是自发反应
D.非自发反应在任何条件下都不能实现
2.能用焓判据判断下列过程的方向的是( )
A.水总是自发地由高处往低处流
B.室温下冰融化成水
C.有序排列的火柴散落时成为无序排列
D.多次洗牌以后,扑克牌毫无规律混乱排列的几率大
3.下列反应中,熵减小的反应是( )
A. (NH4)2CO3(s) = NH4HCO3(s) +NH3(g)
B.2N2O5(g) = 4NO2(g) +O2(g)
C.MgCO3(s) = MgO(s) +CO2(g)
D.2CO(g)= 2C(s) +O2(g)
4. 某化学反应其ΔH = -122 kJ·mol-1,ΔS = +231 kJ·mol-1·K-1,则此反应在下列哪种情况下可自发进行( )
A.在任何温度下都能自发进行
B.在任何温度下都不能自发进行
C.仅在高温下自发进行
D.仅在低温下自发进行
5.石墨、金刚石燃烧的热化学方程式分别为
C(石墨) + O2 (g) = CO2(g) ΔH=-393.51 kJ·mol-1
C(金刚石) + O2 (g) = CO2(g) ΔH=-395.41 kJ·mol-1
关于金刚石和石墨的相互转化,下列说法正确的是( )
A.石墨转化成金刚石是自发进行的过程
B.金刚石转化成石墨是自发进行的过程
C.金刚石比石墨更稳定
D.金刚石比石墨能量低
高中第三节 化学反应的方向课文配套ppt课件: 这是一份高中第三节 化学反应的方向课文配套ppt课件,共25页。
高中化学人教版 (2019)选择性必修1第三节 化学反应的方向完整版课件ppt: 这是一份高中化学人教版 (2019)选择性必修1第三节 化学反应的方向完整版课件ppt,共11页。PPT课件主要包含了学习目标,不能自发进行,不需借助外力,方向性,混乱或无序,混乱度,熵增原理,归纳总结,复合判据等内容,欢迎下载使用。
人教版 (2019)选择性必修1第三节 化学反应的方向习题ppt课件: 这是一份人教版 (2019)选择性必修1第三节 化学反应的方向习题ppt课件,文件包含第2章第3节pptx、第2章第3节doc等2份课件配套教学资源,其中PPT共40页, 欢迎下载使用。













