
高中化学人教版 (2019)必修 第一册第二节 元素周期律教案设计
展开
这是一份高中化学人教版 (2019)必修 第一册第二节 元素周期律教案设计,共7页。教案主要包含了演示实验,总结原因,实验探究1,实验探究2,科学事实等内容,欢迎下载使用。
授课内容
《元素周期律》
教
学
目
标
1)通过探究认识碱金属、卤族元素性质的递变规律,并能从原子结构角度解释同主族元素性质的递变规律。
2)以第三周期元素为例,认识同周期元素性质的递变规律,理解元素周期律的内涵。
3)构建“构—位—性”模型,形成“结构决定性质”的观念,养成化学学科思维。
教学重点
第三周期元素性质的递变规律;元素周期律的含义
教学难点
原子结构与同主族、同周期元素性质的递变规律的关系
教学方法
讲授法、讨论法、实验法等
教学媒体
PPT、希沃、多媒体视频等
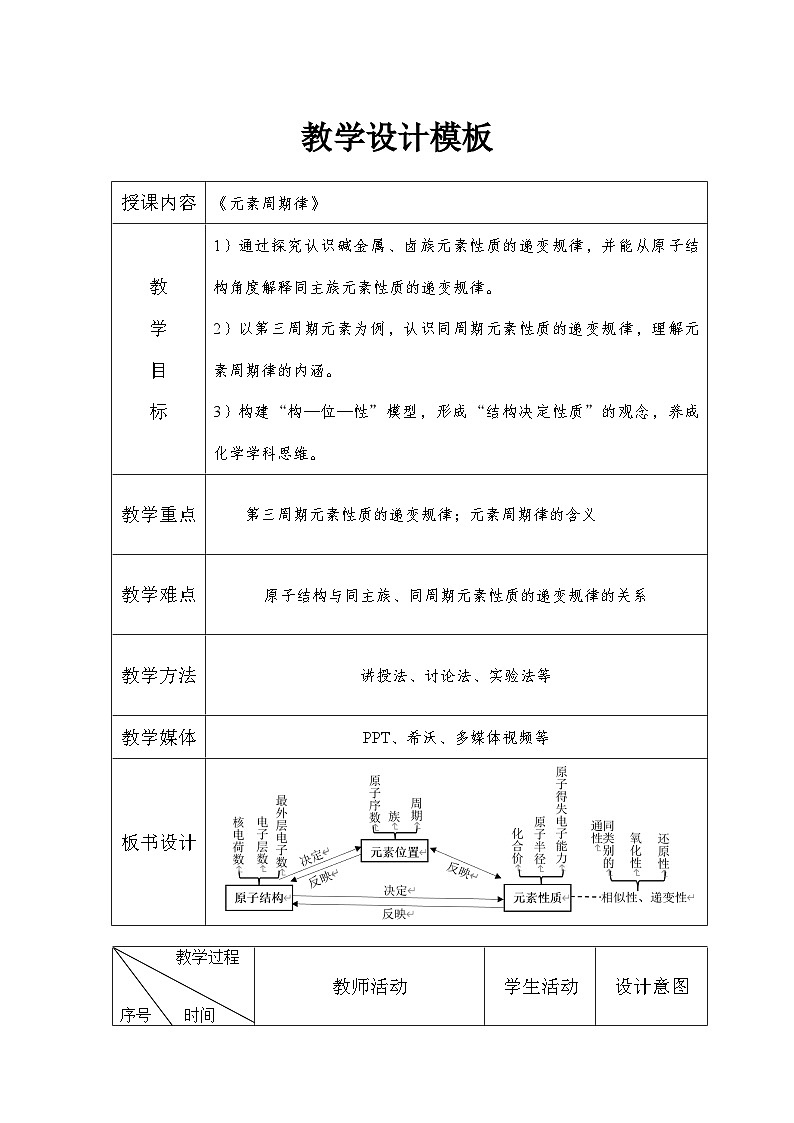
板书设计
教学过程
序号 时间
教师活动
学生活动
设计意图
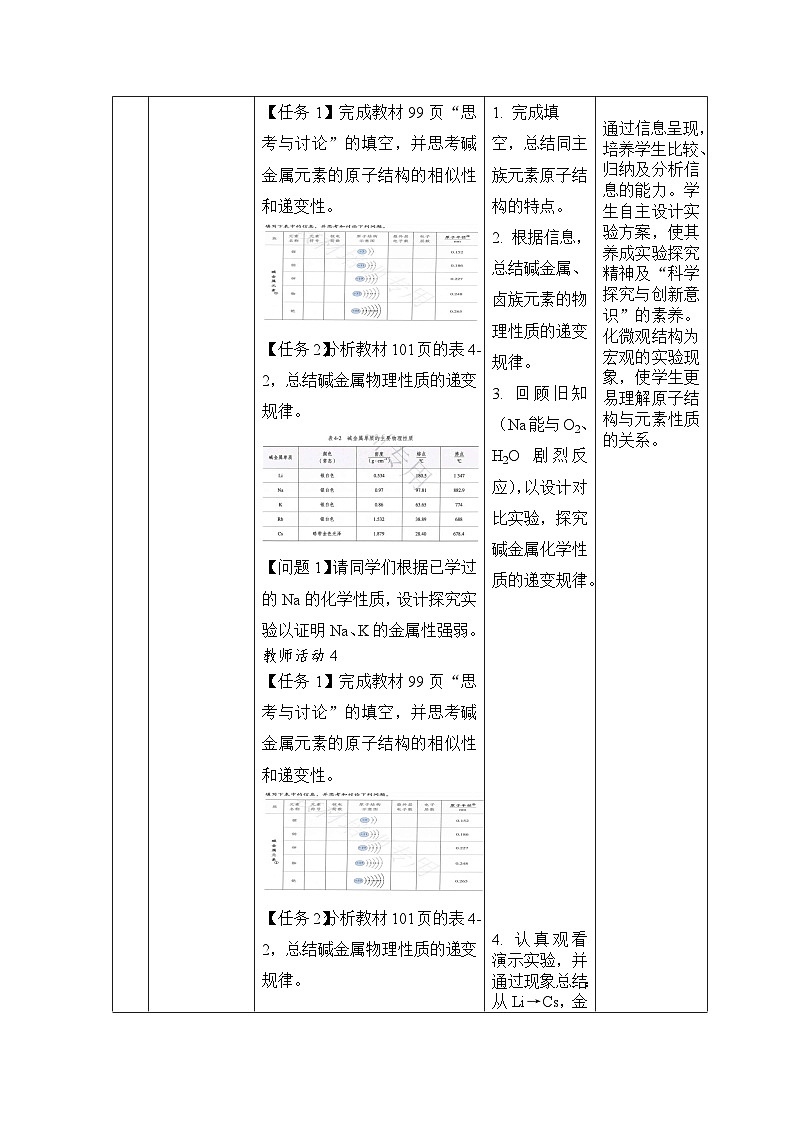
【任务1】完成教材99页“思考与讨论”的填空,并思考碱金属元素的原子结构的相似性和递变性。
【任务2】分析教材101页的表4-2,总结碱金属物理性质的递变规律。
【问题1】请同学们根据已学过的Na的化学性质,设计探究实验以证明Na、K的金属性强弱。
教师活动4
【任务1】完成教材99页“思考与讨论”的填空,并思考碱金属元素的原子结构的相似性和递变性。
【任务2】分析教材101页的表4-2,总结碱金属物理性质的递变规律。
【问题1】请同学们根据已学过的Na的化学性质,设计探究实验以证明Na、K的金属性强弱。
【演示实验】演示Na、K与O2、H2O的反应,提醒学生观察实验现象。
【任务3】根据表格信息,总结卤族元素的原子结构特点。
【任务4】分析教材102页的表4-3及4-4,总结卤族物理、化学性质的递变规律。
【问题2】思考同主族元素的性质从上到下规律性变化的原因是?
【总结原因】
【导入】经过上一节的学习,我们知道同主族元素的性质有相似性和递变性。那么同一周期元素的结构和性质又有怎样的变化规律呢?
【任务1】以小组为单位分析教材107页的表4-5,总结前三周期的原子结构特点:以原子序数为横坐标,最外层电子数、化合价(最高正价、最低负价)及原子半径分别为纵坐标绘制折线图。
【总结】随着原子序数的递增,元素原子的核外电子排布、原子半径和化合价都呈现周期性的变化。
【问题1】以第三周期为例,设计实验方案证明宏观的金属性与非金属性也存在递变规律。
【实验探究1】进行Na、Mg及Al与水的反应,并记录实验现象。
【实验探究2】完成教材109页实验2,以证明Al(OH)3是两性氢氧化物,Al可表现出一定的非金属性。
【科学事实】从Si→Cl,其最高价含氧酸的酸性强弱如下,请据此分析元素的非金属性变化情况。
【总结】同周期元素性质的变化规律及原因分析:
【任务】总结同周期、同主族元素性质的变化规律
【总结】元素周期律的含义:元素性质的周期性变化是元素原子的核外电子排布周期性变化的必然结果。
1. 完成填空,总结同主族元素原子结构的特点。
2. 根据信息,总结碱金属、卤族元素的物理性质的递变规律。
3. 回顾旧知(Na能与O2、H2O剧烈反应),以设计对比实验,探究碱金属化学性质的递变规律。
4. 认真观看演示实验,并通过现象总结:从Li→Cs,金属性逐渐增强;从F→I,非金属性逐渐减弱。
学生活动5
1. 分析数据,画出对应折线图:
2. 设计实验方案:观察与水反应的难易程度来判断金属性强弱。
3. 完成对比实验,仔细观察实验现象,并结合教师的引导,总结出:金属性:Na > Mg > Al。
4. 根据提示信息,总结同周期的非金属性递变规律。
概括归理,领悟元素周期律的内涵:
通过信息呈现,培养学生比较、归纳及分析信息的能力。学生自主设计实验方案,使其养成实验探究精神及“科学探究与创新意识”的素养。化微观结构为宏观的实验现象,使学生更易理解原子结构与元素性质的关系。
通过整合同主族、同周期的性质变化,让学生形成“元素性质的周期性变化是元素原子的核外电子排布周期性变化的必然结果”这一学科大概念,从而构建“结构决定性质”的模型。
课堂形成性 练习
一、判断下列说法是否正确,正确的画“”,错误的画“×”。(3-5分钟)
1. 原子核中质子带正电,中子不带电,核外电子带负电,原子不带电( )
2.所有原子均有质子、中子和电子 ( )
3.同主族自上而下,元素的原子半径逐渐增大 ( )
4. 同周期元素随核电荷数增加,气态氢化物的稳定性逐渐增强 ( )
5. 元素非金属性越强,其氧化物对应的水化物酸性越强 ( )
课后作业
一、我为X元素代言(20-30分钟)
选择一种你最感兴趣的元素,上网查阅相关资料,如在周期表中的位置、发现年代、在地壳中的含量、性质、用途及结构等,并将所有信息整合成一份简报。优秀代言资料将作为墙报展示。
二、趣味创新(20-30分钟)
同学们,快发挥你们无穷的想象力,设计制作出你“心中最美的元素周期表”,并说明设计依据和特点!(形式、主题、色彩等均不限。)
教学反思
在教学过程中存在诸多不足,具体认识如下:
1)未能充分发挥教学机智:虽然课前已经进行了详细的教学设计与计划,但在教学过程中由于学生对象的复杂性导致某些教学环节的效果不太理想。比如在引导学生分析数据绘制出1~18号元素的原子半径及主要化合价的坐标图中,由于学生的数据观察及推理能力各不相同,占用了较长时间,打乱了教学节奏,教学效果也不太理想。在今后的教学过程中,我会更加注重在课堂上对学生进行适当的引导,以培养其对复杂情境问题的推理思考能力。
2)未能进行全面综合的评价:对学生进行适度的评价可进一步实现良好的教学效果。在课堂教学中,我采取小组讨论和实验探究的方式。但我只对学习结果是否正确做出评价,而忽视了学生在讨论及实验过程中的表现(积极参与的态度与合作精神等)。对能力薄弱的同学或未积极参与的学生没有给予充分的关注。在今后的教学中,我会更加注重对学生进行过程性评价,以充分调动其学习积极性。
3)巧用多种多媒体工具,化微观为宏观:本节课的教学内容较抽象,为帮助学生进行微观探析,在课堂上同时结合了多种多媒体工具,比如:生动的实验视频、丰富的微观结构图片及动画模拟等方式,使课堂生动有趣,富含情景化。
相关教案
这是一份高中化学第二节 元素周期律教案,共8页。教案主要包含了学情分析,教材分析,教学方法,教学流程,教学特色等内容,欢迎下载使用。
这是一份高中人教版 (2019)第三节 化学键教案设计,文件包含2023-2024学年人教版-化学-必修-第一册-2019年审核物质结构元素周期律化学键第一课时教学设计docx、2023-2024学年人教版化学-必修-第一册-2019年审核物质结构元素周期律化学键第一课时教学反思docx、2023-2024学年人教版化学-必修-第一册-2019年审核物质结构元素周期律化学键第一课时教学评价docx等3份教案配套教学资源,其中教案共9页, 欢迎下载使用。
这是一份高中第四章 物质结构 元素周期律第二节 元素周期律教案,共6页。教案主要包含了创设情境,实验探究—元素性质的周期性变化,小结与评价等内容,欢迎下载使用。









