高中化学第二节 元素周期律教案
展开学生学习《元素周期律》之前,已经掌握了元素周期律,知道原子核外电子的排布,掌握了以碱金属和卤族元素为例的主族元素性质的相似性和递变性。现在急切想知道同周期元素性质是否也呈现规律性变化。此外,学生的思维、探索和评价能力尚不成熟,还不能成为完全独立探索和评价主体,探索和评价活动需要在教师的指导下,有目的、有计划的进行.
二、教材分析
①本节教材地位
本节《元素周期律》是人教版《化学2》第一章第二节内容。在本节之前,学生已经学钠为代表的碱金属和以氯为代表的卤素在同族中表现的相似性和递变性,这些为本节的学习打下了一定的基础。在本节中,这些知识将更加细化,理论性更强,体系更加完整。学生已经学习了原子的构成、核外电子排布和元素周期表简介等一些基本的物质结构知识,这些为本节的学习奠定了一定的基础。通过学习,可以使学生对于所学元素化合物等知识进行综合、归纳。同时,作为理论指导,学生能更好的把无机化学知识系统化、网络化。本节用第三周期为例,通过典型金属和典型非金属的性质递变,引入元素周期律。
②教学内容
本节以第三周期Na、Mg、Al、Si、P、S、Cl为例,通过实验探究和问题探究,比较归纳出典型金属和非金属元素的性质的递变规律,初步展现元素周期律。
③教学目标
1、知识与技能:
(1)掌握同周期元素的金属性和非金属性随原子序数的增递而呈现周期性变化的规律。
(2)通过实验操作,培养学生实验技能。
2、过程与方法:
(1)自主学习,归纳比较元素周期律。
(2)自主探究,通过实验探究,培养学生探究能力。
3、情感、态度与价值观:培养学生辩证唯物主义观点——量变到质变规律
④教学重难点:
重点:元素的金属性和非金属性随原子序数的递增而呈现周期性变化的规律。
难点:元素性质与原子结构的关系;探究能力的培养。
三、教学方法
教法:问题驱动法、实验探究法、讲授法、讨论、归纳等方法。
学法:自主学习法、探究实验法、合作学习法。
现代教学认为,教学过程是学生主动学习的过程,它不仅是一个认识的过程,而且是一个交流、合作的过程。《化学课程标准》指出 “善于与人合作,具有团队精神”。这要求高中化学课堂的教学要以学生为本,构建合作、评价等新教学模式。
为了突出学生的主体地位,本节课采用评价式教学。教师设置评价任务,引导学生有目的的开展调查、探究,通过评价的标准,让学生自己检验任务的完成情况。评价不仅是教师的教法,更是学生的学法。评价是学生认知目标的最高水平,鼓励学生参与评价活动,学生既能变换角度审视自已的学习,又能在实践中确立并提高自己的评价意识、评价能力,有利于学生的认知发展。
设计意图:引领学生通过亲身参与评价活动来学习,是一种能真正体现学生主动性的学习方式。同学们在评价的要求下,更加主动地学习化学,自觉地将所学的化学知识应用于学生评价之中,逐步形成以问题为动力、以探究为形式、以评价为主体的、以学习能力的养成为目标的学习方式。体会学习的快乐,真正成为学习的主人!
(课前准备:
1.教师的教学准备:多媒体课件制作、实物投影仪,课前预习学案,课内探究学案,课后延伸拓展学案。
2.教具准备:两人一组,实验室内教学。课前打开实验室门窗通风,课前准备好——试管、烧杯、胶头滴管、砂纸、镁带、铝片、试管夹、火柴、酒精灯、酚酞试液、、1m1/L盐酸,1m1/LA1C13溶液、3m1/LNaOH溶液。)
四、教学流程
提出问题:有没有同学在短时间内快速记住元素周期表中112种元素?想必有同学说这个也太难了吧!不过,曾经有一个人做到了!
[多媒体展示] 请同学们欣赏优美的旋律
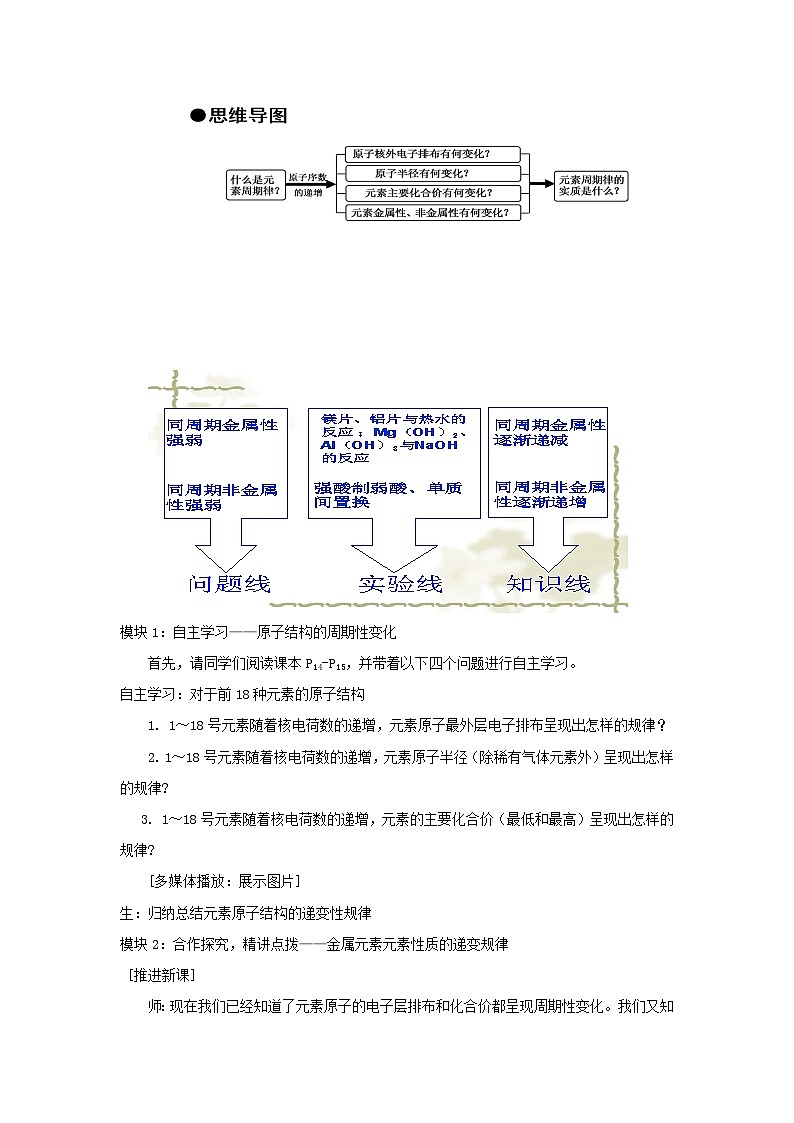
师:欣赏完这优美的旋律,我们不禁对这位智者感到无尽的惊讶与感叹!他根据元素周期表各元素中的某些规律性将其谱写出动听诙谐又便于记忆的旋律。由此我们认识到将繁琐的东西网络化的好处。今天我们来研究学习同周期元素性质的相关规律,以便更好的把无机化学知识系统化、网络化。本节课按照以下思维导图将分三个模块进行我的教学流程。
模块1:自主学习——原子结构的周期性变化
首先,请同学们阅读课本P14-P15,并带着以下四个问题进行自主学习。
自主学习:对于前18种元素的原子结构
1. 1~18号元素随着核电荷数的递增,元素原子最外层电子排布呈现出怎样的规律?
2. 1~18号元素随着核电荷数的递增,元素原子半径(除稀有气体元素外)呈现出怎样的规律?
3. 1~18号元素随着核电荷数的递增,元素的主要化合价(最低和最高)呈现出怎样的规律?
[多媒体播放:展示图片]
生:归纳总结元素原子结构的递变性规律
模块2:合作探究,精讲点拨——金属元素元素性质的递变规律
[推进新课]
师:现在我们已经知道了元素原子的电子层排布和化合价都呈现周期性变化。我们又知道元素性质主要受原子核外电子排布特别是最外层电子的影响,那么,元素性质是否也随原子序数的递增而呈现周期性的变化呢?下面我们就以第三周期元素为例,由第三周期元素性质来建构出同周期元素性质的递变规律。首先我们先通过化学实验来判断元素的金属性强弱。
[多媒体播放:金属性强弱判断依据]1、金属与H2O或与酸反应难易程度。2、置换反应。3、最高价氧化物对应水化物碱性强弱。
实验一.Mg、Al和水的反应
1、分别取一小段镁带、铝条,用砂纸去掉表面的氧化膜,放入2支小试管中,加入2-3ml水,并滴入2滴酚酞溶液。观察现象。过一会儿,用酒精灯给2支试管加热至沸腾,并移开酒精灯,再观察现象。
[多媒体展示出表格] 表(一)Mg、Al和水的反应
实验二:Mg(OH)2 、Al(OH)3的性质
取一支试管,加入2ml,1mO1/L、MgCl2溶液,再逐滴加入3mO1/L、NaOH溶液,把生成的白溶液分盛在两支试管中,加入3m1/LNaOH溶液观察,另取取一支试管,加入1m1/L AlCl3溶液,加入3m1/LNaOH溶液至少产生大量的Al(OH)3白色絮状沉淀,把Al(OH)3沉淀分别盛放于2支试管中,然后,向试管中加入6m1/LNaOH溶液,观察现象。
完成下表:[多媒体展示出表格] 表(二)
解释:为什么根据这些实验现象就可以判断出呢?由于Mg(OH)2不溶于NaOH,而Al(OH)3不仅可以和强酸反应还可以与强碱反应,说明Al(OH)3是两性氢氧化物,碱性Mg(OH)2强于Al(OH)3,所以金属性Mg大于Al。
师:从上面几个实验,我们已经了解了Na、Mg、Al与H2O反应的难易;知道了NaOH、Mg(OH)2、Al(OH)3的性质,请大家在此基础上完成下表。
表(三)
[师说生评] 设计判断Mg、Al金属性强弱的实验,看看能不能实施?
师:1.比较同周期金属性减弱
2.测氢氧化镁和氢氧化铝溶液的PH
3.单质分别和热水的反应……..
生:(判断可行性)
设计意图:这一环节由老师带着学生判断实验方案的可行性,让他们明白这是有别于 “金属性强弱判断依据”这个理论,而是应该怎么设计出可行的实验方案,比如测氢氧化镁和氢氧化铝溶液的PH这是没有实际可操作性!另外,这一环节可以开阔学生的思维,为后面的“生说师评”环节做好铺垫。
模块3:探究性实验——非金属元素元素性质的递变规律
师:第三周期的非金属元素是不是也是呈现周期性变化呢?如何设计实验探究出呢?[多媒体播放:非金属性强弱判断依据]
1、单质与氢气生成气态氢化物的难易程度以及氢化物的稳定性2、单质间的置换反应3、对应阴离子的还原性的强弱4、最高价氧化物的水化物的酸性强弱
生:思考并分组合作讨论
[生说师评] 设计判断Si P S Cl非金属性强弱的实验
生:1.单质与氢气生成气态氢化物的难易程度
2.用磷酸和硅酸钠反应置换出硅酸
3.向硫化钠溶液中通入氯气……..
师:(点评)共同交流得出实验方案
设计意图:根据前面的师说生评环节,开阔了学生的视野,发散了思维,在这一环节再由学生设计,这样梯度设计降低了实验方案的设计难度,让学生在这个环节感受到自己的进步,对自己的收获而感到喜悦。
师:这个环节其实就是我们科学探究的一般步骤:提出问题、猜想假设→设计实验→进行实验→得出结论
[进行实验探究]完成表格
[总结]
设计意图:同周期非金属性递变规律,课本主要是以资料卡片的形式展现,学生印象不深,若设计成探究实验,让学生参与教学活动中,让其既动手练习,又动脑思考,激发他们的思维,从而使其认识上升到认知高度。这样印象深刻,还锻炼了探究能力,促进学习方式的改变。
反思总结,当堂检测
课堂小结:本节课我们重点讨论了第三周期元素性质随原子序数的递增而呈现出周期性变化的规律,并又通过事实,我们得出了元素周期律,希望同学们能掌握这种分析问题的方法,培养自己的创新能力。
1、按原子半径依次增大的一组是 ( )
A.Be、N、F B.Mg、Si、C
C.Na、Mg、Ca D.Cl、S、P
2、下列事实不能说明金属性Na>Mg的是:( )
A. 碱性NaOH >Mg(OH)2
B.Na能与冷水反应,而Mg不能
C. Na不能从MgCl2的溶液中把Mg置换出来
D. Na最外层有一个电子, Mg最外层有2个电子
3、已知:①硫酸比次氯酸稳定;②高氯酸是比硫酸更强的酸;③S2-比Cl-易被氧化;④HCl比H2S稳定;⑤铜与盐酸不反应,与浓硫酸能反应。可说明氯比硫非金属性强的是( )
A. 全部 B. ②③④ C. ②④ D. 除①以外
[布置作业]
1. 完成教材第19页 第1题、第3-5题
2. 课外作业:寻找“元素之最”
板书设计
第二节 元素周期律
五、教学特色
☆本节采用提出问题——分组讨论——汇报点评的方式让所有同学都能积极参与进来。课堂气氛活跃的同时,让各种思维的火花在一起交织,同学们在合作中体会到学习的快乐。其中的“师说生评”、 “生说师评”两个环节设计,让师生、生生交流达到极致,促进学习方式的改变。此外,三个模块的整体教学设计很好的体现“自主学习,合作与探究”。 学生“主动参与,乐于探究,交流与合作”,让学生成为发现者、研究者、探究者,学习更有意义。最终实现,将化学学习立足于实验,用实验的眼光看化学!
☆ 根据学情分析以及对学生学习情况的解,将课本中的探究性实验进行了改编与整合,做到更合乎学情的教学设计。
加入NaOH
Mg(OH)2
Al(OH)3
现 象
反应方程式
结 论
Na
Mg
Al
单质与水(酸)反应
与冷水剧烈反应放出氢气
与冷水反应缓慢,与沸水迅速反应,放出氢气,与酸剧烈反应放出氢气
与酸迅速反应放出氢气
最高价氧化物水化物
NaOH
Mg(OH)2
Al(OH)3
碱性强弱比较
NaOH强碱
Mg(OH)2中强碱
Al(OH)3两性氢氧化物
结 论
随着原子序数的递增,金属性Na> Mg> Al
向H3PO4溶液中加硅酸钠
.向Na2 S 溶液中通入Cl2
现 象
反应方程式
结 论
高中第四章 物质结构 元素周期律第二节 元素周期律教案: 这是一份高中<a href="/hx/tb_c161998_t8/?tag_id=27" target="_blank">第四章 物质结构 元素周期律第二节 元素周期律教案</a>,共6页。教案主要包含了创设情境,实验探究—元素性质的周期性变化,小结与评价等内容,欢迎下载使用。
高中化学人教版 (2019)必修 第一册第四章 物质结构 元素周期律第二节 元素周期律教案: 这是一份高中化学人教版 (2019)必修 第一册第四章 物质结构 元素周期律第二节 元素周期律教案,共11页。
人教版 (2019)必修 第一册第三节 化学键教案: 这是一份人教版 (2019)必修 第一册第三节 化学键教案,共9页。教案主要包含了教学目标,教学重难点,教学方法,教学过程,新课引入,学生活动,教师活动,教师提问等内容,欢迎下载使用。