




所属成套资源:高中化学必修一教学课件【人教版新教材】
人教版 (2019)必修 第一册第一节 钠及其化合物教学课件ppt
展开
这是一份人教版 (2019)必修 第一册第一节 钠及其化合物教学课件ppt,共45页。PPT课件主要包含了学习目标和核心素养,课本P34,钠及其化合物,CaOFe2O3,CO2,酸性氧化物,碱性氧化物,氧化钠的化学性质,组成元素一样,金属氧化物等内容,欢迎下载使用。
教学目标1,掌握氧化钠和过氧化钠的化学性质2,掌握碳酸钠和碳酸氢钠的共性和差异性。3,掌握鉴别它们的方法
核心素养1,通过氧化钠和过氧化钠性质的探究,建立通过实验得到性质的认知模型2,通过掌握氧化钠和过氧化钠性质、碳酸钠和碳酸氢钠的共性和差异性,让学生明白性质决定用途,同时训练学生认识事物和全面分析事物的逻辑思维能力
请你说说!
你了解我国蛟龙号深海载人潜水器吗?
蛟龙号深海载人潜水器中潜水员氧气的来源如何?
蛟龙号深海载人潜水器中潜水员呼吸产生的二氧化碳,若用过氧化钠(Na202)处理,可以产生O2
01 氧化钠和过氧化钠
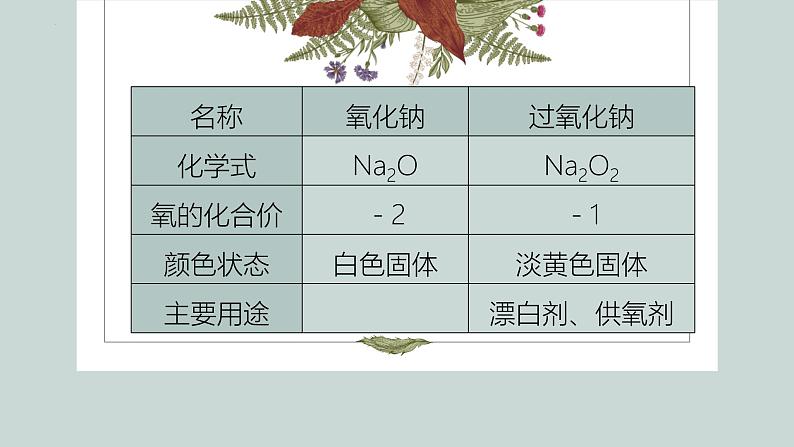
思考与讨论(1)回忆前面做过的实验,描述氧化钠和过氧化钠的颜色、状态。(2)氧化钠与水的反应和氧化钙与水的反应类似,请写出氧化钠与水反应的化学方程式。
依据类别共性类比典型代表物
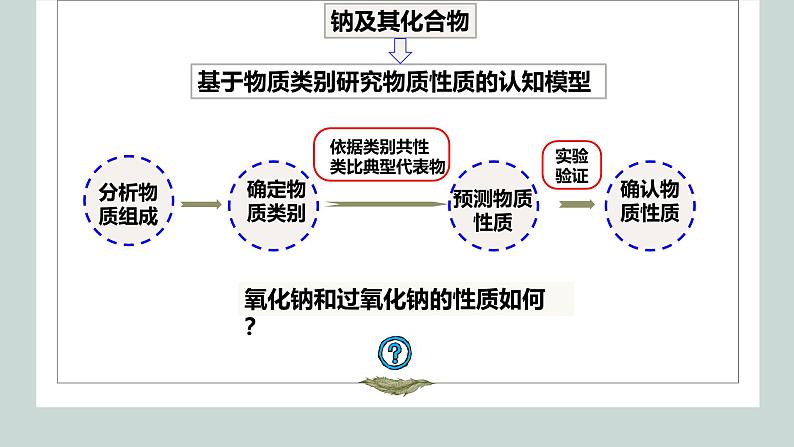
基于物质类别研究物质性质的认知模型
氧化钠和过氧化钠的性质如何?
请你试试!
用类推的方法推测氧化钠和过氧化钠的性质!
基于物质类别研究物质性质
如何认识Na2O和Na2O2的性质?
酸性氧化物 + 水 → 酸
酸性氧化物 + 碱 → 盐 + 水
碱性氧化物 + 水 → 碱
碱性氧化物 + 酸 → 盐 + 水
酸性氧化物+碱性氧化物→盐
氧化钠与氧化钙一样都属于碱性氧化物,请你写出氧化钠与水、二氧化碳、盐酸反应的化学方程式。
(1)氧化钠与水反应:_____________________。(2)氧化钠与盐酸反应:__________________________。(3)氧化钠与二氧化碳反应:_____________________。
Na2O+H2O===2NaOH
Na2O+2HCl===2NaCl+H2O
Na2O+CO2===Na2CO3
请你预测!
基于物质类别研究物质性质,Na2O2的性质如何?
Na2O + H2O === 2NaOH
Na2O + CO2 === Na2CO3
Na2O + 2HCl === 2NaCl+H2O
研究物质性质的一般程序
2Na2O2+2H2O===4NaOH+O2↑
-1 -2 0
2Na2O2+2H2O == 4NaOH+O2↑
失去2e-,化合价升高,被氧化
得到2e-,化合价降低,被还原
过氧化钠和水反应放热,生成氧气和氢氧化钠
过氧化钠有强氧化性和漂白性
进一步探讨
潜水艇中、呼吸面具的氧气怎么来的?
取1~2 g Na2O2于棉花上, 用棉花将Na2O2包住,将棉团放入坩埚中,用一支玻璃导管对棉团吹气,注意观察实验现象并记录。
为什么脱脂棉会燃烧,燃烧的条件是什么?是什么在起作用?
过氧化钠与CO2发生反应放出热量
过氧化钠与CO2反应生成有氧气
2Na2O2+2CO2=2Na2CO3+O2
2Na2O2+2CO2 = 2Na2CO3+O2
过氧化钠和二氧化碳反应放热,生成氧气和碳酸钠
Na2O2可作供氧剂,在呼吸面具和潜水艇中应用
过氧化钠和氧化钠性质对比
2Na2O2+2H2O=4NaOH+O2↑
Na2O+H2O=2NaOH
Na2O+CO2=Na2CO3
2Na2O2 + 4HCl = 4NaCl + 2H2O + O2 ↑
Na2O+HCl=NaCl+H2O
你知道吗?
面粉发酵或制作油条,用到发酵粉和食用碱的成分是什么?
NaHCO3和Na2CO3
碳酸钠、碳酸氢钠的水溶性及酸碱性的实验探究
观察碳酸钠、碳酸氢钠的外观并进行描述
02 碳酸钠和碳酸氢钠
[实验2-4]在两支试管中分别加入少量Na2CO3和NaHCO3(各约1 g),完成下列实验,并将实验现象和相应的结论填入下表。
问题:根据包装袋上说明书中储存方法的不同,你能得到哪些信息可以鉴别他们?
请同学们根据你们的猜想以小组为单位设计实验方案 并动手实验。
Na2CO3溶于水放出热量;Na2CO3比NaHCO3易溶于水;Na2CO3溶液碱性比NaHCO3溶液强。
温度计示数升高,溶解放热;
温度计示数降低,溶解吸热
加水结块成晶体Na2CO3·xH2O
[实验2-5]
如图所示,分别加热Na2CO3和NaHCO3,观察现象,比较Na2CO3和NaHCO3的热稳定性。
碳酸钠与碳酸氢钠的热稳定性对比实验
Na2CO3很稳定,受热不易发生分解
为何不用碳酸钠来治疗胃酸过多,而是采用碳酸氢钠?
Na2CO3碱性较强,反应速率较慢,不适宜做胃药。NaHCO3碱性较强,反应速率快,可以治疗用于治疗胃酸过多。
胃痛类型很多,胃溃疡不能吃含有小苏打的药物进行治疗,反而会加重病情!
碳酸钠与碳酸氢钠用途对比
碳酸钠和碳酸氢钠用途(1)碳酸钠:重要的化工原料,在玻璃、肥皂、合成洗涤剂、造纸、纺织、石油等方面有广泛的应用。(2)碳酸氢钠:是发酵粉的主要成分,可以做治疗胃酸过多的药剂。
原料:食盐、氨、二氧化碳等反应原理:1.生成碳酸氢钠和氯化铵NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl(碳酸氢钠在溶液中溶解度较小,易析出)2.制取碳酸钠2NaHCO3=Na2CO3+CO2↑+H2O
NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl(副产品)
NaHCO3的溶解度最小,会析出晶体.
你知道吗?
节日燃放的五彩缤纷的烟花是怎么来的吗?
把熔嵌在玻璃棒上的铂丝(或光洁无锈的铁丝)放在酒精灯(最好用煤气灯)外焰上灼烧,至与原来的火焰颜色相同为止。用铂丝蘸取碳酸钠溶液,在外焰上灼烧,观察火焰的颜色。
很多金属或它们的化合物在灼烧时都会使火焰呈现出特征颜色。根据火焰呈现的特征颜色,可以判断试样所含的金属元素,化学上把这样的定性分析操作称为焰色试验。
金属及化合物的焰色反应
相关课件
这是一份高中化学人教版 (2019)必修 第一册第一节 钠及其化合物精品课件ppt,共44页。PPT课件主要包含了“滴水点灯”的奥秘,氧化钠和过氧化钠,碳酸钠和碳酸氢钠,Na2O和Na2O2,NaOH等内容,欢迎下载使用。
这是一份人教版 (2019)必修 第一册第一节 钠及其化合物背景图免费课件ppt,共60页。PPT课件主要包含了结块变成晶体,NaCl,蓝色钴玻璃,Na2O2,Na2CO3,NaHCO3等内容,欢迎下载使用。
这是一份人教版 (2019)必修 第一册实验活动1 配制一定物质的量浓度的溶液多媒体教学ppt课件,共36页。









