





初中化学人教版(2024)九年级下册(2024)课题2 常见的酸和碱课文ppt课件
展开1. 在一定条件下化学反应可以实现物质转化。2. 基于实验事实进行证据推理、建构模型并推测物质及其变化的思维能力。3.初步形成认识化学反应的系统思维意识。4. 通过向稀氢氧化钠溶液中滴加稀盐酸的实验探究,培养学生观察与描述、合作与交流的能力。
蚊虫叮咬以后,疼痛难忍,涂上一点肥皂水或牙膏即可缓解疼痛,你知道其中的道理吗?
无法从实验现象观察反应是否发生,需要借助指示剂。
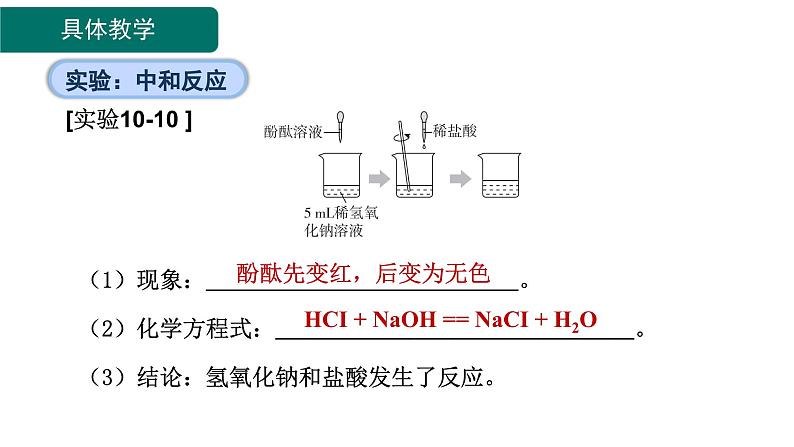
向NaOH溶液中加稀盐酸
(1)现象: 。(2)化学方程式: 。(3)结论:氢氧化钠和盐酸发生了反应。
酚酞先变红,后变为无色
HCI + NaOH == NaCI + H2O
【思考1】实验中观察到什么现象?为什么要加入酚酞溶液?什么时候酸和碱恰好完全反应?
【思考2】能用紫色石蕊溶液代替酚酞溶液完成上述探究吗?
小结:此实验是借助指示剂变色来验证反映物消失,从而证明酸碱发生了反应。
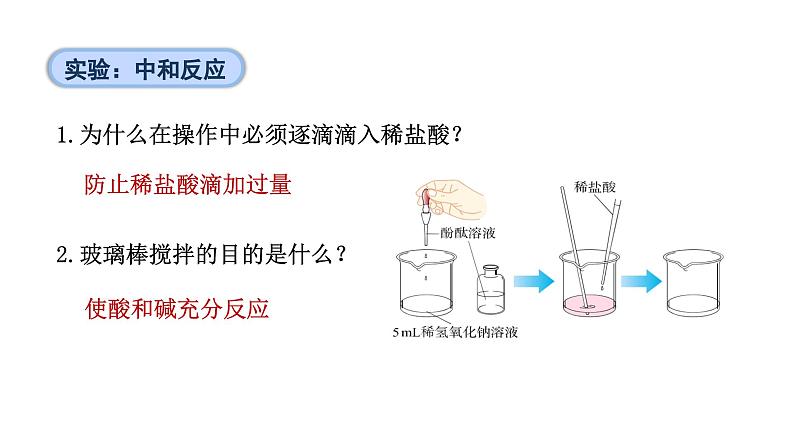
1.为什么在操作中必须逐滴滴入稀盐酸?
2.玻璃棒搅拌的目的是什么?
(1) 2HCl + Ca(OH)2 = (2) H2SO4 + Ca(OH)2 = (3) 3HCl + Al(OH)3 = (4) H2SO4 + 2NaOH = (5) H2SO4 + Ba(OH)2 = (6) 2HCl + Cu(OH)2 = (7) H2SO4 + Mg(OH)2 =
CaCl2 + 2H2O
CaSO4 + 2H2O
AlCl3 + 3H2O
Na2SO4 + 2H2O
BaSO4 ↓ + 2H2O (生成白色沉淀)
CuCl2 + 2H2O (蓝色沉淀消失)
MgSO4 + 2H2O (白色固体溶解)
书写下列中和反应的化学方程式
概念:由金属离子和酸根离子构成的化合物叫作盐。
化合物分为四大类:酸、碱、盐、氧化物
(1)有盐和水生成的反应 是中和反应。
概念: 作用生成 的反应。
(2)中和反应是 反应。中和反应不是基本反应类型。
盐酸和氢氧化钠反应的微观过程
可溶性酸和碱发生中和反应的实质:
H+ + OH- == H2O
酸滴入碱中开始时, ;加酸后, ;酸和碱完全中和时, ;酸过量时, 。
碱性变弱,向PH=7靠近
氢氧化钠具有强烈的腐蚀性,而且成本高。
【思考】为什么不选用氢氧化钠来改良酸性土壤?
农业上,酸性土壤中加入适量的 中和。
处理工厂污水,如硫酸厂的污水加 中和,其化学方程式 ,印染厂碱性污水加 来中和。
H2SO4 + Ca(OH)2 == CaSO4 + 2H2O
患胃酸过多症的病人服用 性药物如 中和过多的胃酸。用化学方程式解释其原理: 。可以用氢氧化钠吗?
3HCl+Al(OH)3 == AlCl3 +3H2O
蚂蚁、蚊虫、蜜蜂叮咬会分泌蚁酸(甲酸 HCOOH)使皮肤肿痛;可涂抹适量含碱性物质如 的药水。
肥皂水、氨水(NH3·H2O)
1.下列应用与中和反应无关的是( )A.用盐酸除铁锈 B.用硫酸处理印染厂的碱性废水C.服用含氢氧化镁的药物治疗胃酸过多症 D.将熟石灰撒在土壤中改良酸性土壤
3.芋艿是一种常见的食物,在去皮时流出的汁液中含有碱性物质——皂角甙,皮肤沾上它会感觉到奇痒,下列物质止痒效果最好的是( ) A.食盐 B.肥皂水 C.料酒 D.食醋
2.下列做法不科学的是( )A.用碳酸水浇偏碱性的土壤 B.用熟石灰给鱼塘消毒C.用氢氧化钠中和酸性土壤 D.用食醋除去水垢
4.《奔跑吧,兄弟》中,队员用水枪将酚酞溶液喷射到对方的“名牌”上,立即变红色。事先浸泡“名牌”的溶液可能是( ),如果要使红色褪去,喷射的液体可能是( ) A.水 B.柠檬酸 C.食盐溶液 D.石灰水
5.下列各组物质之间的反应中,必须要加入指示剂才能判断反应发生的是( ) A. CaCO3和HCl B. Zn和H2SO4 C. NaOH和H2SO4 D. Ca(OH)2和CO2
初中课题2 酸和碱的中和反应课文内容课件ppt: 这是一份初中<a href="/hx/tb_c9871_t3/?tag_id=26" target="_blank">课题2 酸和碱的中和反应课文内容课件ppt</a>,共25页。PPT课件主要包含了pH范围,酸性增强,碱性增强,pH7溶液显中性,pH试纸,标准比色卡,测定方法,注意事项,酸溶液,碱溶液等内容,欢迎下载使用。
初中化学人教版九年级下册课题2 酸和碱的中和反应备课ppt课件: 这是一份初中化学人教版九年级下册<a href="/hx/tb_c9871_t3/?tag_id=26" target="_blank">课题2 酸和碱的中和反应备课ppt课件</a>,共27页。PPT课件主要包含了CONTENTS,内容提要,学习目标,PART1,知识回顾,中性溶液pH=7,酸性溶液pH<7,碱性溶液pH>7,思考一下,PART2等内容,欢迎下载使用。
初中化学人教版九年级下册第十单元 酸和碱课题2 酸和碱的中和反应说课课件ppt: 这是一份初中化学人教版九年级下册<a href="/hx/tb_c9871_t3/?tag_id=26" target="_blank">第十单元 酸和碱课题2 酸和碱的中和反应说课课件ppt</a>,共32页。PPT课件主要包含了CONTENTS,内容提要,学习目标,PART1,中和反应,知识回顾,碱的化学性质,导入新课,实验验证,A不发生反应等内容,欢迎下载使用。













