





初中化学人教版九年级下册课题2 酸和碱的中和反应课堂教学ppt课件
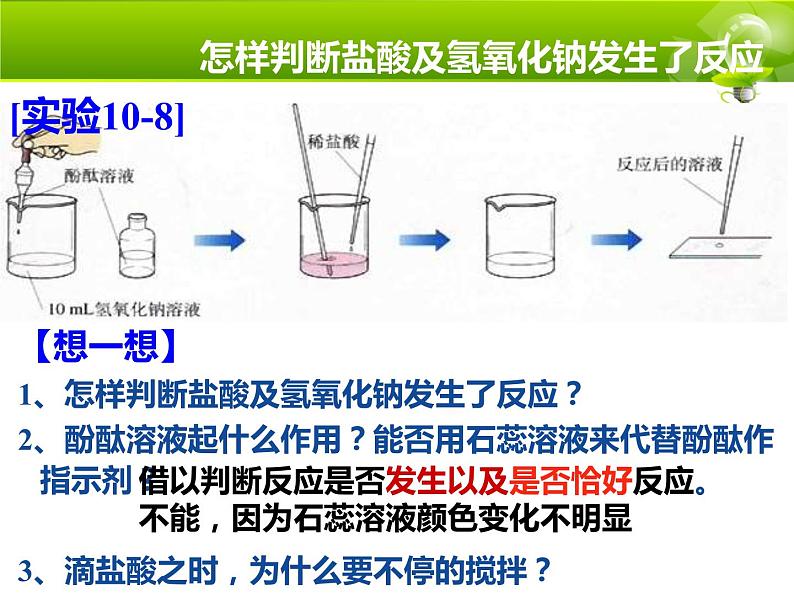
展开【想一想】1、怎样判断盐酸及氢氧化钠发生了反应?2、酚酞溶液起什么作用?能否用石蕊溶液来代替酚酞作指示剂?3、滴盐酸之时,为什么要不停的搅拌?
怎样判断盐酸及氢氧化钠发生了反应?
借以判断反应是否发生以及是否恰好反应。不能,因为石蕊溶液颜色变化不明显
①酚酞作用:指示酸碱中和是否恰好达到了反应的终点
②玻璃棒作用:使反应充分进行
溶液颜色由红色恰好变为了无色
③慢慢的滴加稀盐酸是为了防止酸过量
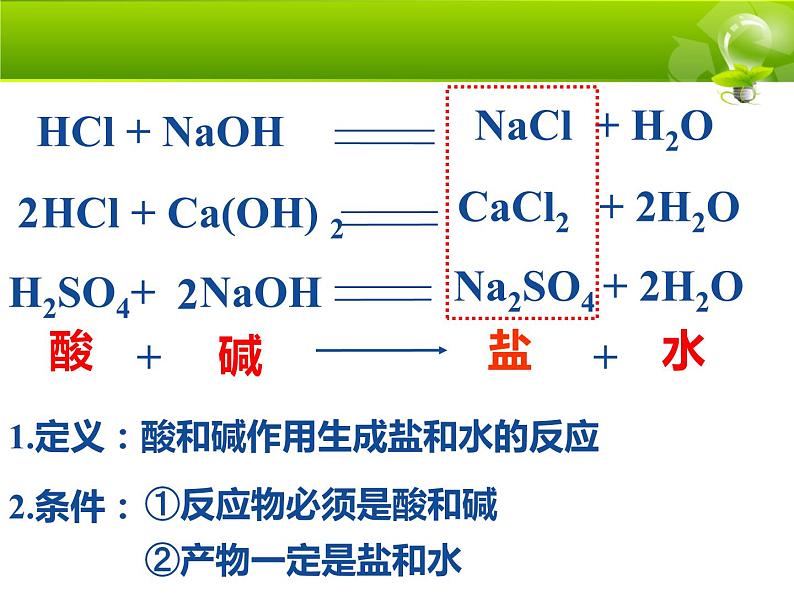
NaCl + H2O
HCl + Ca(OH) 2H2SO4+ NaOH
CaCl2 + 2H2ONa2SO4 + 2H2O
1.定义:酸和碱作用生成盐和水的反应
①生成盐和水的反应不一定是中和反应
如:Fe2O3+6HCl=2FeCl3+3H2O
③中和反应是复分解反应的一种
CO2 +2NaOH = Na2CO3 + H2O
下列反应,属于中和反应的是( )A CO2 +2NaOH == Na2CO3 + H2OB CuO + 2HCl == CuCl2 + H2OC Cu(OH)2 + H2SO4 == CuSO4 + 2H2OD CuSO4 + 2NaOH == Na2SO4 +Cu(OH)2
[想一想]从微观角度看,为什么NaOH和HCl反应?
酸溶液中的H+和碱溶液中的OH-反应生成水分子的过程。
[练习]写出下列中和反应的化学方程式
Fe(OH)3 + HCl = FeCl3 + H2O
Ba(OH)2 + H2SO4 = BaSO4 ↓+ H2O
3 3
如图所示,发现忘记了滴加指示剂.为了确定盐酸与氢氧化钠是否恰好完全反应,小田从烧杯中取了少量反应后的溶液于一支试管中,并向试管中滴加几滴无色酚酞试液,振荡,观察到酚酞试液不变色.于是她得出“两种物质已恰好完全中和”的结论. (1)你认为她得出的结论是否正确 ,理由是 , (2)请你设计一个实验,探究上述烧杯中的溶液是否恰好完全中和.
如果盐酸滴加过量,滴入酚酞试液也不变色
取反应后的溶液于试管,滴加紫色石蕊试液,试液变红,盐酸过量;若试液不变红,恰好中和
1.农业上调节土壤的酸碱性:
①硫酸厂酸性污水用熟石灰(成本低)中和
Ca(OH)2 + H2SO4 = CaSO4 + 2H2O
②印染厂碱性废水可加入硫酸进行中和
[注意]NaOH有强腐蚀性,不能用来改良酸性土壤!
2NaOH + H2SO4 = Na2SO4 + 2H2O
②蚊虫叮咬(呈酸性):涂弱碱性物质等减轻疼痛
如:氨水、牙膏、肥皂水、Na2CO3溶液等
①治疗胃酸过多:用Al(OH)3、Mg(OH)2 、NaHCO3等
[注意]1、NaOH、Ca(OH)2有强腐蚀性,不能用来治疗胃酸过多
Al(OH)3 + 3HCl = AlCl3 + 3H2O
Mg(OH)2 + 2HCl = MgCl2 + 2H2O
b.蒸馒头-用纯碱
2、NaHCO3 不能用来治疗胃穿孔
NaHCO3 + HCl = NaCl + H2O+CO2↑
1.溶液酸碱性可以用酸碱指示剂来测定。
2.溶液酸碱度(酸碱性强弱程度)常用pH来表示,
pH的范围通常在0~14之间。
3.pH与溶液酸碱性的关系
2、碱溶液的pH一定大于7,但pH>7的溶液 不一定是碱溶液,如盐Na2CO3溶液
[注意]1、酸溶液的pH一定小于7,但pH<7的溶液 不一定是酸溶液,如盐(NH4)2SO4溶液
4.测定pH最简便的方法---pH试纸(黄色)
取一小块pH试纸放在玻璃片(或表面皿或点滴板)上,用玻璃棒蘸取少量待测液滴到试纸上,在半分钟(30s)时间以内,把试纸显示的颜色后与标准比色卡比较,得出被测液的pH值。
②不能直接把试纸浸入试液,否则会污染试液
③不能先用蒸馏水润湿pH试纸,否则会将溶液稀释,测出来的pH就不准确。
①pH试纸一般粗略测定pH,其结果取整数
④检验气体酸碱性,可将试纸润湿,如:氨气(NH3);
酸性溶液,酸性减弱-pH变大
碱性溶液,碱性减弱-pH变小
中性 -pH不变
⑤同一物质的溶液如果浓度变化,那其pH也发生变化;
⑥为什么要在30s内:时间长了,可能会与待测溶液发生反应,或者是与空气中的某些物质发生反应,酸碱性发生改变,导致结果不真实。
有一瓶无色溶液的pH是9.5,取少量注入试管中,再滴入几滴酚酞试液,溶液呈______色,如果要使试管中溶液的pH降为5,可以采取______________________的方法。
[拓展]土壤(固体)酸碱性的测定
取少量土壤于烧杯中,加水溶解,静置,取上层清液。用玻璃棒蘸取滴到pH试纸上,将试纸显示的颜色与标准比色卡比较,读出其pH
5、改变溶液酸碱度的方法
⑴如何使酸性溶液pH升高?
⑵如何使碱性溶液pH降低?
⑴化工生产中许多反应必须在一定pH溶液里才能进行;
⑵在农业生产中,农作物一般适宜在pH为7 或接近7的土壤中生长;
四.了解溶液的酸碱度的重要意义。
⑶测定雨水的pH,可以了解空气的污染情况;
因溶解有二氧化碳,正常雨水的pH约为5.6,酸雨(NO2、SO2溶于水)的pH小于5.6
⑷测定人体内或排出的液体的pH,可以了解人体的 健康状况。
人体内的一些液体和排泄物的正常pH范围
讨论:溶液的酸碱度不同对头发影响 , 性溶液对头发有保护作用,溶液______性越强,对头发损害越大。
⑸溶液酸碱度对头发的影响
洗发时,用过洗发剂后再用护发剂,这样对头发有保护作用。你能解释这是为什么吗?
洗发水呈碱性,能够帮助头发的毛鳞片打开,彻底清洁的同时还能吸收营养;护发素呈酸性,能关闭头发的毛鳞片,使头发顺滑。
复习巩固: 1. 请你从下列所给药品中,选择合适的物质,用两种方法证明稀硫酸与氢氧化钠溶液反应后,硫酸有剩余。请将有关内容填在下表中。 所给药品:酚酞试液、石蕊试液、稀盐酸、铁粉、铜粉、碳酸钠粉末、氯化钠固体、氧化铜粉末
取少量反应后的溶液一试管中,滴入2滴紫色石蕊试液
取少量反应后的溶液于试管中,加入少量铁粉
铁粉溶解,有气泡产生,溶液由无色变成浅绿色
2.某校化学兴趣小组的同学做氢氧化钠溶液和稀硫酸中和反应实验时,由于实验中忘记加酚酞试液,不知二者是否恰好完全中和,因此他们对反应后溶液中的溶质是什么提出猜想,并展开探究. [提出问题]溶液申的溶质可能是什么? [猜想]他们的猜想:溶质只有硫酸钠; 你的猜想:(1)溶质是 ; (2)溶质是 . [设计实验] 请选择你的其中一种猜想,设计实验加以证明(答出方法、现象、结论)
Na2SO4、H2SO4
Na2SO4、NaOH
3.用熟石灰中和一定量的盐酸时,溶液的pH与加入的熟石灰质量的关系如右图所示。熟石灰与盐酸反应的化学方程式为 当加入熟石灰mg时,溶液中的溶质为 。 若改用ng氢氧化钠与相同量盐酸反应,所得溶液的pH 7(填“>”、“<”或“=”)
2HCl + Ca(OH) 2=CaCl2 + 2H2O
CaCl2 、HCl
m熟石灰= m氢氧化钠= ng =74g
2HCl+Ca(OH)2=CaCl2+2H2O
2HCl+2NaOH=2NaCl+2H2O
(氢氧化钠不足,溶液显酸性)
4、向一定量的氢氧化钡溶液中逐滴滴加稀硫酸至过量,下列图像与该反应事实相符合的是( )
5、已知完全中和一定量的某盐酸,需100g8%的氢氧化钠溶液,若改用100g8%的氢氧化钾溶液,则反应后溶液的pH( )A.大于7B.小于7C.等于7D.无法确定
1.盐酸和硫酸属于酸,酸在水溶液中能解离出H+和酸根离子。
酸 → H+ + 酸根离子(如SO42-、NO3-、Cl-)
2.氢氧化钠和氢氧化钙属于碱,碱在水溶液中能解离出金属离子和OH-。
碱→ OH- + 金属离子(如Na+、 K+)
3.酸和碱在生产和生活中有广泛的用途。
1.酸和碱都能与指示剂反应,指示剂遇酸或碱显示不同的颜色。
2.酸能与多种活泼(H前)金属反应,生成盐和氢气,如:
Mg+2HCl=MgCl2+H2↑
Zn+2HCl=ZnCl2+H2↑
Fe+2HCl=FeCl2+H2↑
Fe+H2SO4=FeSO4+H2↑
Zn+H2SO4=ZnSO4+H2↑
Mg+H2SO4=MgSO4+H2↑
3.酸能与某些金属氧化物反应,生成盐和水,如:
Fe2O3+ HCl= FeCl3+ H2O
Fe2O3+ H2SO4=Fe2(SO4)3+ H2O
4.酸能与某些盐反应,生成另一种酸和另一种盐,如:
2HCl+CaCO3===CaCl2+H2O+CO2↑
H2SO4+BaCl2 ===BaSO4 ↓ +2HCl
5.酸和碱能发生中和反应,生成盐和水,如:
HCl + NaOH= NaCl +H2O
H2SO4+ Ca(OH)2 = CaSO4 + 2H2O
6.碱能与某些非金属氧化物反应,生成盐和水,如:
Ca(OH)2+CO2=CaCO3 ↓+ H2O
2NaOH+CO2= Na2CO3 + H2O
2NaOH+SO3=Na2SO4 + H2O
4.碱能与某些盐反应,生成另一种碱和另一种盐,如:
2NaOH+CuSO4===Na2SO4+Cu(OH)2 ↓
3NaOH+FeCl3===3NaCl+Fe(OH)3 ↓
初中化学人教版九年级下册课题2 酸和碱的中和反应优质课件ppt: 这是一份初中化学人教版九年级下册<a href="/hx/tb_c9871_t3/?tag_id=26" target="_blank">课题2 酸和碱的中和反应优质课件ppt</a>,共41页。PPT课件主要包含了想一想,金属离子,酸根离子,中和反应的实质,H2O,小试牛刀,中和反应的应用,探究结论,反思提升等内容,欢迎下载使用。
初中化学人教版九年级下册课题2 酸和碱的中和反应教学演示课件ppt: 这是一份初中化学人教版九年级下册课题2 酸和碱的中和反应教学演示课件ppt,文件包含第2课时溶液酸碱度的表示法pHpptx、第1课时中和反应pptx、第1课时中和反应DOCX、第2课时溶液酸碱度的表示法pHDOCX、1021酸碱中和反应mp4、1022生活中一些物质的pH值mp4等6份课件配套教学资源,其中PPT共42页, 欢迎下载使用。
初中化学人教版九年级下册第十单元 酸和碱课题2 酸和碱的中和反应图片课件ppt: 这是一份初中化学人教版九年级下册第十单元 酸和碱课题2 酸和碱的中和反应图片课件ppt,共16页。PPT课件主要包含了金属离子,酸根离子,处理工厂的废水,中和硫酸工厂废水,用于医药等内容,欢迎下载使用。














