





高中化学苏教版 (2019)必修 第一册第三单元 人类对原子结构的认识背景图课件ppt
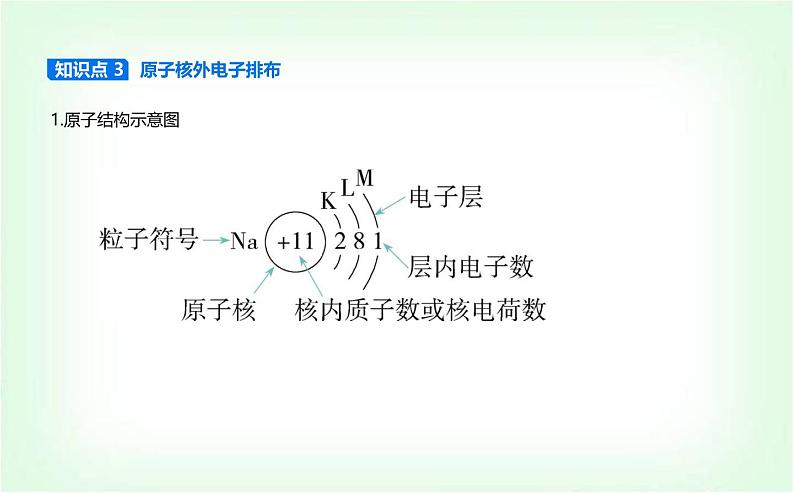
展开1.原子是由带正电的原子核和带负电的核外电子构成的,原子核又是由质子和中子构成的,质子带正电,中子不带电。2.质量数:将原子核内所有的质子和中子的相对质量取整数,加起来所得到的数值。3.原子的表示符号 X表示质子数是Z、质量数为A的一种X原子。4.存在关系(1)质量数(A)=质子数(Z)+中子数(N)。(2)原子:核电荷数=质子数=核外电子数;阴离子:质子数=核外电子数-电荷数;阳离子:质子数=核外电子数+电荷数。
知识点 2 原子核的构成
5.核素和同位素(1)核素:具有一定数目质子和一定数目中子的一种原子。(2)同位素:质子数相同,质量数(或中子数)不同的核素互称为同位素。
知识点 3 原子核外电子排布
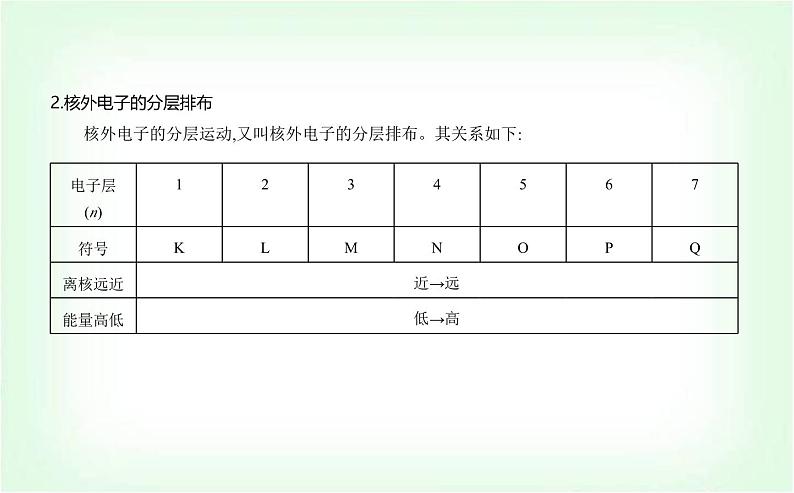
2.核外电子的分层排布 核外电子的分层运动,又叫核外电子的分层排布。其关系如下:
3.元素的化学性质与原子核外电子排布的关系(1)化学反应的特点:原子核不发生变化,但最外层电子数可能发生变化。(2)化合价和核外电子排布的关系①活泼金属在反应中,一般失去电子,在生成物中呈现正化合价。②活泼非金属在反应中,一般得到电子,在生成物中呈现负化合价。
知识辨析1.16O2和18O2互为同位素。这种说法对吗?2.一个原子不容易得到电子,那么它一定易失去电子。这种说法对吗?3.元素的化学性质由其原子的核外电子数决定。这种说法对吗?
一语破的1.不对。16O2和18O2均为单质分子,而同位素讨论的是同一元素的不同原子(或核素)。2.不对。稀有气体原子既不容易得到电子也不容易失去电子。3.不对。原子的最外层电子数决定了元素的化学性质,一般,最外层电子数小于4的原子易失 电子,最外层电子数大于4的原子易得电子,最外层电子数等于4的原子,既不易得电子也不易 失电子。
定点 1 原子的结构
2.元素、核素、同位素的比较
典例1 医学上常用 C呼吸法诊断幽门螺旋杆菌,考古时通过测定 C所占比例来测定文物年代。下列有关 C和 C的说法不正确的是( )A.这两种原子中均含有6个质子B C的结构示意图为 C.二者互为同位素D.二者化学性质几乎完全相同
思路点拨 互为同位素的原子,其质子数和核外电子数相同,中子数、质量数不同,化学性质 几乎完全相同。
典例2 钍是一种放射性金属元素,金属钍呈灰色光泽,质地柔软,化学性质较活泼。钍广泛分 布在地壳中,是一种应用前景十分可观的能源材料。230Th和232Th是钍的两种核素,232Th可以转 化成233U。下列说法正确的是 ( )A.钍元素的原子序数是232B.钍元素原子只由原子核构成C.232Th转化成233U是化学变化D.230Th和232Th的物理性质不同
思路点拨 对于陌生元素原子的考查,熟悉原子的构成是解题关键;不同元素原子之间的相 互转化为核反应,不属于化学变化。从微观上看,化学反应前后原子的种类、个数没有变 化。
解析 Th元素的原子序数不是232,232Th的质量数为232,A错误;Th元素的原子由原子核和核 外电子构成,B错误;232Th转化成233U是核反应,不属于化学变化,C错误;230Th和232Th的质子数相 同、中子数不同,互为同位素,二者具有相同的最外层电子数,化学性质几乎完全相同,物理性 质不同,D正确。
1.元素性质与原子核外电子排布的关系(1)当原子最外层电子数达到8(只有一个电子层时为2)时,该原子处于稳定结构,化学性质较 稳定。(2)元素在化合物中的常见化合价与原子的电子层结构,特别是最外层电子数有关。例如:① 钠原子最外层只有1个电子,在反应中容易失去这个电子而达到稳定结构,因此钠元素在化合 物中显+1价。②氯原子最外层有7个电子,只需得到1个电子便可达到稳定结构。2.核外电子排布规律的理解 核外电子的排布规律中的各项是相互联系的,不能孤立地理解。电子总是尽可能先排布 在能量较低的电子层里,即电子先排满K层,当K层排满再排L层,排满L层才排M层,但是不能 继续向后推,即电子不是排满M层后,再排N层。如钾原子的结构示意图不为图1,虽然M层排9
定点 2 原子核外电子排布
个电子并不超过18个(排满),但是与最外层不能超过8个电子相矛盾,所以钾的原子结构示意 图如图2所示。
典例1 下列叙述正确的是 ( )A.中子数为10的氧原子:10OB.同种元素原子的质子数相同C.Cl-的结构示意图: D.1H2、2H2、3H2互为同位素
思路点拨 元素不同,核素肯定不同,质子数也一定不同,当核素之间质子数相同而中子数不 同时,互为同位素。
典例2 根据给出的原子或离子结构示意图,回答下列问题(填字母): (1)核外电子排布相同的是 。(2)属于同种元素的是 。(3)属于金属元素的是 。(4)属于稀有气体元素的是 ,稀有气体一般不参与化学反应的原因是 。(5)写出D的单质参加化学反应后所得离子的结构示意图: 。
高中化学苏教版 (2019)必修 第一册专题2 研究物质的基本方法第一单元 研究物质的实验方法评课课件ppt: 这是一份高中化学苏教版 (2019)必修 第一册<a href="/hx/tb_c4002493_t3/?tag_id=26" target="_blank">专题2 研究物质的基本方法第一单元 研究物质的实验方法评课课件ppt</a>,共19页。PPT课件主要包含了关键能力定点破,物理方法等内容,欢迎下载使用。
高中化学第三单元 人类对原子结构的认识教课ppt课件: 这是一份高中化学<a href="/hx/tb_c4002495_t3/?tag_id=26" target="_blank">第三单元 人类对原子结构的认识教课ppt课件</a>,共20页。PPT课件主要包含了原子结构示意图,原子的组成等内容,欢迎下载使用。
高中化学苏教版 (2019)必修 第一册专题2 研究物质的基本方法第一单元 研究物质的实验方法背景图课件ppt: 这是一份高中化学苏教版 (2019)必修 第一册<a href="/hx/tb_c4002493_t3/?tag_id=26" target="_blank">专题2 研究物质的基本方法第一单元 研究物质的实验方法背景图课件ppt</a>,共19页。PPT课件主要包含了关键能力定点破,物理方法等内容,欢迎下载使用。














