



高中化学苏教版 (2019)选择性必修1第二单元 化学反应的方向与限度优秀当堂达标检测题
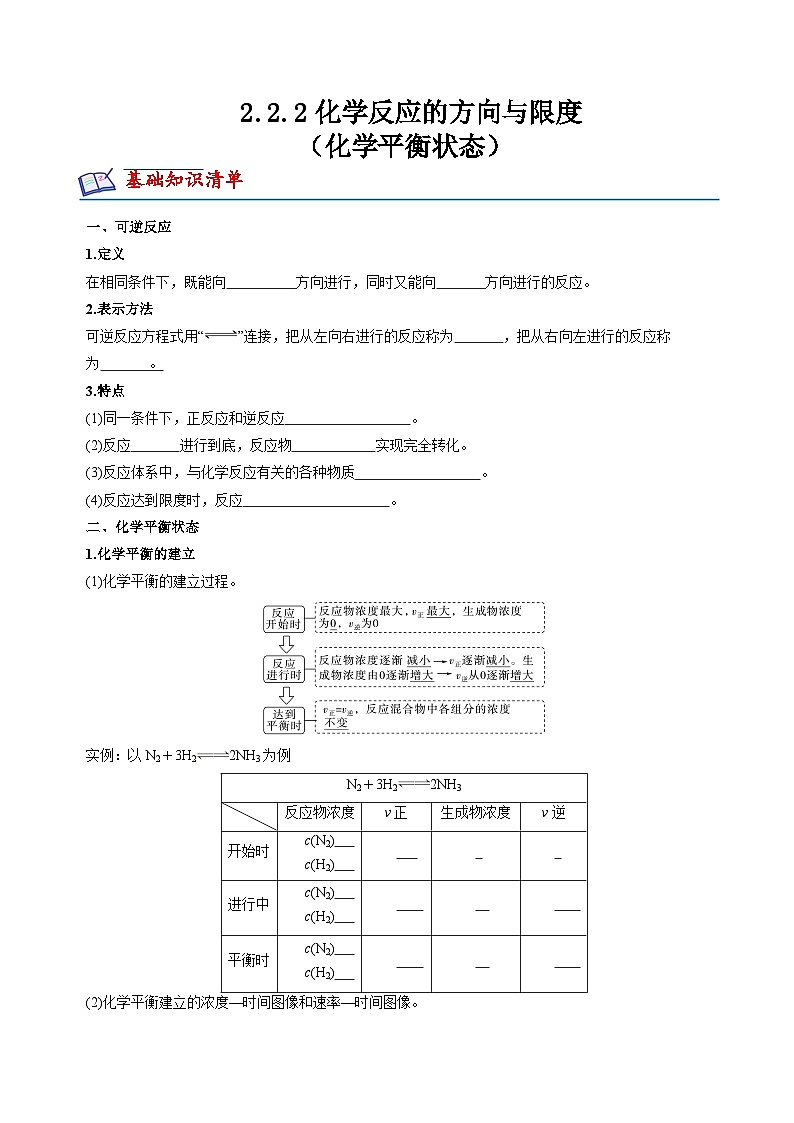
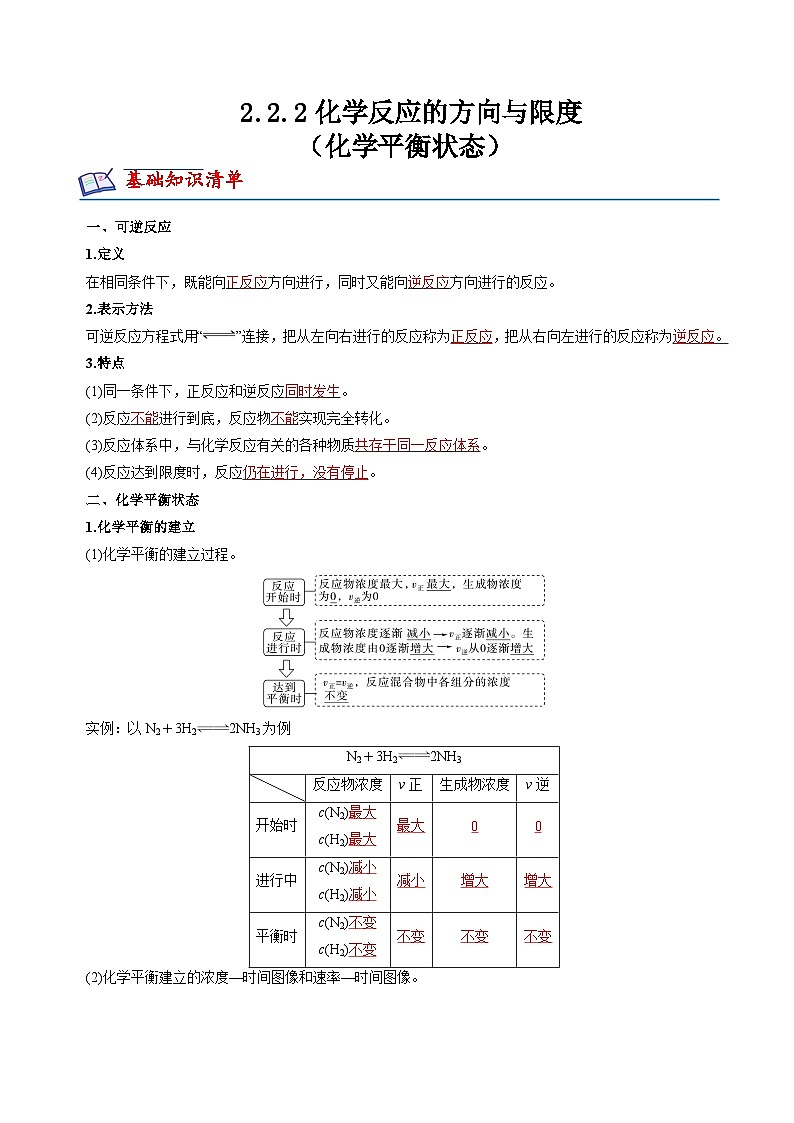
展开一、可逆反应
1.定义
在相同条件下,既能向 方向进行,同时又能向 方向进行的反应。
2.表示方法
可逆反应方程式用“”连接,把从左向右进行的反应称为 ,把从右向左进行的反应称为 。
3.特点
(1)同一条件下,正反应和逆反应 。
(2)反应 进行到底,反应物 实现完全转化。
(3)反应体系中,与化学反应有关的各种物质 。
(4)反应达到限度时,反应 。
二、化学平衡状态
1.化学平衡的建立
(1)化学平衡的建立过程。
实例:以N2+3H22NH3为例
(2)化学平衡建立的浓度—时间图像和速率—时间图像。
2.化学平衡状态
当外界条件不变时,可逆反应进行到一定程度,反应物和生成物的 不再随时间而发生变化,称之为化学平衡状态。
3.化学平衡状态的特征
4.化学反应达到平衡状态的判断方法
1.直接标志
(1)v正=v逆
①同一种物质的生成速率等于 ;
②在化学方程式同一边的不同物质的生成速率和消耗速率之比等于 ;
③在化学方程式两边的不同物质的生成(或消耗)速率之比等于 。
(2)各组分的浓度保持一定
①各组分的浓度 时间的改变而改变;
②各组分的质量分数、物质的量分数、体积分数 时间的改变而改变。
2.间接标志——“变量不变”
(1)反应体系中的总压强不随时间的改变而变化(适用于反应前后气体分子数不等的反应)。
(2)对于反应混合物中存在有颜色物质的可逆反应,若体系中颜色不再改变,则反应达到平衡状态。
(3)根据平均摩尔质量(即平均相对分子质量)计算公式M=eq \f(m(气总),n(气总)),若M在反应过程中是一变量,则平均摩尔质量(平均相对分子质量)保持不变,反应达到平衡状态。
(4)对同一物质而言,断裂化学键的物质的量与形成化学键的物质的量相等。
课后分层练
1.在一定体积的密闭容器中进行反应:N2(g)+3H2(g)2NH3(g)。已知反应过程中某一时刻N2、H2、NH3的浓度分别为0.1 ml·L-1、0.3 ml·L-1、0.2 ml·L-1。当反应达到平衡时,可能存在的数据是( )
A.N2为0.2 ml·L-1,H2为0.6 ml·L-1
B.N2为0.15 ml·L-1
C.N2、H2均为0.18 ml·L-1
D.NH3为0.4 ml·L-1
2.在一密闭容器中进行反应:2SO2(g)+O2(g)2SO3(g)。已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2 ml·L-1、0.1 ml·L-1、0.2 ml·L-1。当反应达到平衡时可能存在的数据是( )
A.SO2为0.4 ml·L-1,O2为0.2 ml·L-1
B.SO3为0.25 ml·L-1
C.SO2、SO3均为0.15 ml·L-1
D.SO3为0.4 ml·L-1
3.可逆反应在一定条件下达到化学平衡时,下列说法正确的是( )
A.正反应速率等于逆反应速率,且都为零
B.反应物和生成物浓度相等
C.反应体系中混合物的组成保持不变
D.反应物断开化学键吸收的能量等于生成物形成化学键所放出的能量
4.可逆反应:N2(g)+3H2(g)2NH3(g)的正、逆反应速率可用各反应物或生成物浓度的变化来表示。下列各关系中能说明反应已达到平衡状态的是( )
A.3v正(N2)=v正(H2)
B.v正(N2)=v逆(NH3)
C.2v正(H2)=3v逆(NH3)
D.v正(N2)=3v逆(H2)
5.在密闭容器中进行反应:X2(g)+3Y2(g)2Z2(g),若X2、Y2、Z2的初始浓度分别为0.1 ml·L-1、0.3 ml·L-1、0.2 ml·L-1,当反应达到平衡后,各物质的浓度可能是( )
①X2为0.2 ml·L-1 ②Y2为0.1 ml·L-1
③Z2为0.3 ml·L-1 ④Y2为0.6 ml·L-1
A.①② B.②③ C.③④ D.①④
6.14CO2与碳在高温条件下发生反应:14CO2+C2CO,达到化学平衡后,平衡混合物中含14C的粒子有( )
A.14CO2 B.14CO2、14CO
C.14CO2、14CO、14C D.14CO
7.有关化学平衡状态的特征,下列说法不正确的是( )
A.所有的化学反应都存在化学平衡状态
B.平衡时反应已达到最大限度,但反应并未停止
C.平衡时各组分的浓度不一定相等
D.化学平衡状态是一种动态平衡
8.对于可逆反应:4NH3(g)+5O2(g)4NO(g)+6H2O(g),则下列叙述中正确的是( )
A.达到化学平衡时,4v正(O2)=5v逆(NO)
B.若单位时间内生成n ml NO的同时,消耗n ml NH3,则反应达到平衡状态
C.若NH3、O2、NO、H2O的分子数之比为4∶5∶4∶6时,反应达到化学平衡状态
D.平衡时,化学反应速率的关系是2v正(NH3)=3v正(H2O)
9.一定条件下,向密闭容器中充入1 ml NO和1 ml CO进行反应:NO(g)+CO(g) eq \f(1,2)N2(g)+CO2(g),测得化学反应速率随时间的变化关系如图所示,其中处于化学平衡状态的点是( )
A.d点 B.b点
C.c点 D.a点
10.在一定温度下,向a L密闭容器中加入1 ml O2和2 ml NO,发生如下反应:O2(g)+2NO(g)2NO2(g),此反应不一定达平衡的是( )
A.容器内压强不随时间变化
B.容器内各物质的浓度不随时间变化
C.容器内O2、NO、NO2的浓度之比为1∶2∶2
D.单位时间内生成1 ml O2,同时生成2 ml NO2
11.在容器中充入SO2和只由18O原子形成的氧气(18O2)。在一定条件下达到平衡时,18O( )
A.只存在于O2中
B.只存在于O2和SO3中
C.只存在于SO2和SO3中
D.存在于SO3、SO2和O2中
12.已知298 K时,合成氨反应N2(g)+3H2(g)2NH3(g) ΔH=-92.0 kJ•ml-1,将此温度下的1 ml N2和3 ml H2充入一密闭容器中,在催化剂存在时进行反应。测得反应放出的热量(假设测量过程中没有能量损失) ( )
A.一定小于92.0 kJ B.一定大于92.0 kJ
C.一定等于92.0 kJ D.无法确定
13.下列对化学反应限度的叙述中,错误的是( )
A.任何可逆反应在给定的条件下的进程都有一定的限度,不同反应的限度不同
B.可逆反应的最大转化率不能达到100%,所以可逆反应不容易发生
C.化学反应达到平衡时,反应物和生成物的浓度均不再改变,但物质间的转化仍在进行
D.改变反应条件,化学反应限度可能改变
14.如图是可逆反应X2+3Y22Z在反应过程中反应速率(v)与时间(t)的关系曲线,下列叙述正确的是( )
A.t1时,只发生正方向的反应
B.t2时,反应未达到最大限度
C.t2~t3时,反应不再发生
D.t2~t3时,各物质的浓度不再发生变化
15.一定条件下,向2 L恒容密闭容器中充入1 ml COCl2(g),发生反应COCl2(g)Cl2(g)+CO(g),反应过程中测得的有关数据如下表所示,下列说法不正确的是( )
A.6 s之后反应达到平衡状态,容器内的压强不再随时间的延续而改变
B.达到6 s时,反应停止,不再进行
C.8 s时,反应容器中各物质的浓度不再发生变化
D.生成Cl2的平均反应速率:v(0~2 s)>v(2~4 s)
16.在密闭容器中进行反应:X2(g)+3Y2(g)2Z(g),X2、Y2、Z的起始浓度分别为0.2 ml·L-1、0.6 ml·L-1、0.4 ml·L-1,当平衡时,下列数据肯定不正确的是( )
A.X2为0.4 ml·L-1,Y2为1.2 ml·L-1
B.Y2为1.0 ml·L-1
C.X2为0.3 ml·L-1,Z为0.2 ml·L-1
D.Z为0.6 ml·L-1
17.已知反应N2(g)+3H2(g)2NH3(g) ΔH=-92.4 kJ•ml-1,下列说法正确的是( )
A.向密闭容器中充入1 ml N2和3 ml H2,充分反应后,放出92.4 kJ的热量
B.向密闭容器中充入一定量N2和H2,放出92.4 kJ的热量时,生成了2 ml NH3
C.向密闭容器中充入1 ml N2和足量H2,充分反应后,放出92.4 kJ的热量
D.向密闭容器中充入2 ml NH3,充分反应后,吸收了92.4 kJ的热量
18.在一定条件下,将0.3 ml CO2和0.2 ml H2充入2 L密闭容器中,进行反应:CO(g)+H2O(g)CO2(g)+H2(g)。下列关于该反应建立平衡的说法正确的是( )
A.反应刚开始时,生成物浓度最大,正反应速率最小
B.随着反应的进行,反应物浓度逐渐减小,正反应速率逐渐增大
C.达到平衡状态时反应体系中CO2的浓度为0 ml/L
D.该反应建立平衡过程中v(速率)R000Rt(时间)图像如图所示
19.在一定温度下的恒容密闭容器中,以下说法能表明反应:A(s)+2B(g)C(g)+D(g)已达平衡的是( )
A.混合气体的压强不变
B.混合气体的密度不变
C.每消耗2 ml B,同时生成1 ml C
D.C和D的浓度比不变
20.在一恒容密闭容器中发生反应:2SO2(g)+O2(g)2SO3(g)。起始时,c(SO2)=0.3 ml•L-1、c(O2)=0.2 ml•L-1、c(SO3)=0.4 ml•L-1。在一定条件下,当反应达到平衡时,下列各物质的物质的量浓度关系可能正确的是( )
A.c(SO2)=0.7 ml•L-1
B.c(SO2)+c(O2)=1.1 ml•L-1
C.c(SO3)+c(SO2)=0.65 ml•L-1
D.c(SO2)+c(O2)+c(SO3)=0.78 ml•L-1
21.一定条件下,0.3 ml X(g)与0.3 ml Y(g)在容积固定的密闭容器中发生反应:X(g)+3Y(g)2Z(g) ΔH=-a kJ
•ml-1(a>0),下列说法正确的是( )
A.反应一段时间后,X与Y的物质的量之比仍为1:1
B.达到平衡时,反应放出的热量小于0.1a kJ
C.混合气体密度保持不变,说明反应已达到平衡
D.达到平衡后,若向平衡体系中充入稀有气体,Z的正反应速率将增大
22.在体积固定的密闭容器中,发生反应:2CO(g)+4H2(g)CH3CH2OH(g)+H2O(g)。下列叙述中不能说明上述反应已达到化学反应限度的是( )
A.2v正(CO)=v逆(H2)
B.混合气体密度不变
C.混合气体的压强不变
D.CH3CH2OH的浓度不变
23.绝热容器中发生反应:3Z(s)X(g)+2Y(g) ΔH=a kJ•ml-1(a>0)。下列说法不正确的是( )
A.将0.3 ml Z置于容器中充分反应生成气体的物质的量一定小于0.3 ml
B.容器中放入1.5 ml Z,达到化学平衡状态时,反应吸收的热量为0.5a kJ
C.容器温度不变,反应已经达到平衡
D.气体平均摩尔质量不变,不能说明反应达到化学平衡状态
24.698 K时,向V L的密闭容器中充入2 ml H2(g)和2 ml I2(g),发生反应H2(g)+I2(g)2HI(g) ΔH=-26.5 kJ•ml-1,测得各物质的物质的量浓度与时间的关系如图所示。
请回答下列问题:
(1)V= 。
(2)该反应达到最大限度的时间是 ,该时间内平均反应速率v(HI)= 。
(3)该反应达到平衡状态时, (填“吸收”或“放出”)的热量为 。
(4)达到平衡时H2的转化率为 。
(5)平衡混合气体中HI的体积分数为 。
1.一定条件下,在体积为1 L的密闭容器中,1 ml X和1 ml Y 进行反应:2X(g)+Y(g)Z(g),下列叙述能证明该反应已达到化学平衡状态的是( )
A.X的百分含量不再发生变化
B.c(X)∶c(Y)∶c(Z)=2∶1∶1
C.容器内原子总数不再发生变化
D.同一时间内消耗2n ml X的同时生成n ml Z
2.可逆反应:2NO2(g)2NO(g)+O2(g)在恒容的密闭容器中进行,达到平衡状态的标志是( )
①单位时间内生成n ml O2的同时生成2n ml NO2
②单位时间内生成n ml O2的同时生成2n ml NO
③用NO2、NO、O2表示的反应速率的比为2∶2∶1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的压强不再改变的状态
⑦混合气体的平均相对分子质量不再改变的状态
A.①④⑥⑦ B.②③⑤⑦
C.①③④⑤ D.全部
3.一定温度下,在一容积不变的密闭容器中发生可逆反应:2X(g)Y(g)+Z(s),以下不能说明该反应达到化学平衡状态的是( )
A.混合气体的密度不再变化
B.反应容器中Y的质量分数不变
C.X的分解速率与Y的消耗速率相等
D.单位时间内生成1 ml Y的同时生成2 ml X
4.一定条件下,将NO2与SO2以体积比为1∶2置于密闭容器中,发生反应:NO2(g)+SO2(g)SO3(g)+NO(g) ΔH=-41.8 kJ·ml-1,下列能说明反应达到平衡状态的是( )
A.体系压强保持不变
B.混合气体颜色保持不变
C.SO3和NO的体积比保持不变
D.每消耗1 ml SO3的同时生成1 ml NO2
5.在一密闭容器中进行反应2SO2(g)+O2(g)2SO3(g),已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.6 ml•L-1、0.3 ml•L-1、0.6 ml•L-1,当反应至正、逆反应速率相等时,可能存在的状态是( )
A.SO2为1.2 ml•L-1、O2为0.6 ml•L-1
B.SO2为0.75 ml•L-1
C.SO2、SO3均为0.45 ml•L-1
D.SO3为1.2 ml•L-1
6.工业上常用煤和水作原料经过多步反应制得氢气,其中一步反应的原理为CO(g)+H2O(g) eq \(,\s\up11(催化剂),\s\d4(△))CO2(g)+H2(g),下列选项的条件中可判断该反应达到平衡状态的是( )
A.单位时间内消耗1 ml H2O的同时生成1 ml的H2
B.两个H—O键断裂的同时有两个C===O键断裂
C.反应容器内的气体密度不再发生变化
D.混合气体的平均相对分子质量不发生变化
7.在密闭容器中有如下反应:X2(g)+Y2(g)2Z(g)。已知:X2、Y2、Z的起始浓度分别为0.1 ml/L、0.3 ml/L、0.2 ml/L,在一定条件下,当反应达到平衡时,各物质的浓度(单位ml/L)可能是( )
A.X2为0.2 B.Y2为0.2
C.Z为0.3 D.Z为0.4
8.在密闭容器中进行如下反应:X2(g)+Y2(g)2Z(g),已知X2、Y2、Z的起始浓度分别为0.1 ml
•L-1、0.3 ml•L-1、0.2 ml•L-1,在一定条件下,当反应达到平衡时,各物质的浓度有可能是( )
A.X2为0.2 ml•L-1
B.Y2为0.2 ml•L-1
C.Z为0.3 ml•L-1
D.Z为0.45 ml•L-1
9.对一定温度下的恒容容器中,开始时投入等物质的量的A、B进行如下可逆反应:A(g)+3B(g)2C(g),下列叙述能作为平衡标志的是( )
①A、B、C的分子数之比为1:3:2;
②单位时间内生成a ml A,同时生成3a ml B;
③A、B、C各自的浓度不变;
④混合气体的总压强不变;
⑤C的物质的量占混合气体总物质的量的百分比φ(C)不变;
⑥混合气体的密度不变;
⑦混合气体的平均摩尔质量不变
A.①②③④⑤⑥⑦ B.②③④⑤⑦
C.③④⑤⑦ D.③④⑦
10.锡、铅均为ⅣA族元素,在含Pb2+的溶液中投入Sn会发生置换反应生成Sn2+,反应过程中金属离子(R2+)的物质的量浓度随时间的变化情况如图所示。下列说法错误的是( )
A.0~10 s内,v(Sn2+)=0.044 ml·L-1·s-1
B.反应的离子方程式为Pb2++SnPb+Sn2+
C.5 s时,正、逆反应速率相等,反应达到平衡
D.12 s时,5c(Sn2+)=11c(Pb2+)
11.我国科学家王亮在CO2合成燃料CH4的催化剂选择方面取得了重大突破,其反应原理如下:CO2(g)+4H2(g)CH4(g)+2H2O(g) ΔH=-165.0 kJ•ml-1 ,在恒容密闭容器中通入1 ml CO2与4 ml H2,下列情形能表示该反应达到平衡状态的是( )
A.容器内混合气体的平均摩尔质量不再改变
B.容器内气体的密度不再改变
C.eq \f(n(CO2),n(H2))的值保持不变
D.v正(CO2)=4v逆(H2)
12.在一个绝热的固定容积的密闭容器中,发生可逆反应mA(g)+nB(g)pC(g)+qD(s),当m、n、p、q为任意整数时,一定可以作为反应达到平衡的标志是( )
①体系的压强不再改变
②体系的温度不再改变
③体系的密度不再变化
④各组分质量分数不再改变
A.①②③ B.①②③④
C.②③④ D.③④
13.汽车尾气在催化的作用下脱硝脱碳的主要原理为2NO+2CON2+2CO2。在一定条件下的密闭容器中,用传感器测得该反应在不同时间NO、CO浓度如下表。下列说法正确的是( )
A.反应前2 s内的平均反应速率为v(N2)=3.5×10-3 ml•L-1•s-1
B.当2v正(NO)=v逆(N2)时,说明反应已达到化学平衡状态
C.该反应在3~5 s内的平均反应速率为0
D.由表中数据可知,反应3 s时达到平衡状态,此时反应已经停止
14.用Cl2生产某些含氯有机物时会生成副产物HCl,利用下列反应可实现氯的循环利用:4HCl(g)+O2(g)2Cl2(g)+2H2O(g) ΔH<0。在恒温恒容的密闭容器中,充入一定量的反应物发生上述反应,下列示意图正确且能说明反应最终达到平衡状态的是( )
A.①②③ B.②③ C.③ D.④
15.1 133 K时,向某恒容密闭容器中充入等物质的量的CO(g)和H2(g),发生反应:CO(g)+3H2(g)CH4(g)+H2O(g),容器内的压强与时间的关系如图所示,下列有关该反应的判断不正确的是( )
A.当容器内混合气体的平均摩尔质量不再改变时,该反应达到了平衡状态
B.当CO的分压是H2的2倍时,该反应达到了平衡状态
C.当1 ml O—H键断裂同时有2 ml C—H键形成时,该反应达到了平衡状态
D.当容器内混合气体的密度不再改变时,该反应达到了平衡状态
16.向绝热恒容的密闭容器中,加入足量的碳和一定量NO,发生反应C(s)+2NO(g)CO2(g)+N2(g) ΔH<0,测得CO2浓度随时间变化如表,下列说法正确的是( )
A.该反应100 s后才到达平衡
B.0~80 s用NO来表示反应的速率为0.075 ml•L-1•s-1
C.达到平衡状态时,2v正(NO)=v逆(CO2)
D.混合气体的压强不再随时间变化而变化,该反应一定达到了平衡状态
17.T ℃时,将0.10 ml N2O4气体放入1 L密闭容器中,发生反应N2O4(g)2NO2(g),实验数据如图。下列说法错误的是( )
A.混合气体的密度始终保持不变
B.a点v(正)>v(逆)
C.前60 s内,v(NO2)=2.0×10-3 ml•L-1•s-1
D.c(N2O4):c(NO2)=1:2时,说明反应已达平衡状态
18.一定温度下,在10 L密闭容器中加入5 ml SO2和3 ml O2,发生反应:2SO2(g)+O2(g)2SO3(g),10 min时,反应达到平衡状态,此时有3 ml SO2发生了反应。
(1)反应生成了________________ ml SO3,v(SO2)=________________。
(2)平衡时SO3的浓度是__________________,SO2的转化率是________________。
(3)平衡时容器内气体的总物质的量为__________________ml。
(4)物质的浓度不再改变标志着该反应已达平衡,下列还可以说明该反应已达平衡的是________(填序号)。
①体系内压强不再改变
②容器内气体的密度不再改变
③混合气体的平均相对分子质量不再改变
④v正(SO3)=2v逆(O2)
⑤n(SO3)∶n(O2)∶n(SO2)=2∶1∶2N2+3H22NH3
反应物浓度
v正
生成物浓度
v逆
开始时
c(N2)
c(H2)
进行中
c(N2)
c(H2)
平衡时
c(N2)
c(H2)
t/s
0
2
4
6
8
n(Cl2)/ml
0
0.30
0.39
0.40
0.40
时间/s
0
1
2
c(NO)/(ml•L-1)
9.50×10-3
4.50×10-3
2.50×10-3
c(NO)/(ml•L-1)
9.00×10-3
4.00×10-3
2.00×10-3
时间/s
3
4
5
c(CO)/(ml•L-1)
1.50×10-3
1.50×10-3
1.50×10-3
c(NO)/(ml•L-1)
1.00×10-3
1.00×10-3
1.00×10-3
反应时间/s
0
80
90
100
110
CO2浓度/(ml•L-1)
0.00
0.30
0.32
0.33
0.33
高中化学苏教版 (2019)选择性必修1第二单元 化学能与电能的转化优秀随堂练习题: 这是一份高中化学苏教版 (2019)选择性必修1<a href="/hx/tb_c4009311_t7/?tag_id=28" target="_blank">第二单元 化学能与电能的转化优秀随堂练习题</a>,文件包含124化学能与电能的转化电解原理的应用分层练习原卷版docx、124化学能与电能的转化电解原理的应用分层练习解析版docx等2份试卷配套教学资源,其中试卷共24页, 欢迎下载使用。
苏教版 (2019)选择性必修1第二单元 化学能与电能的转化精品练习题: 这是一份苏教版 (2019)选择性必修1<a href="/hx/tb_c4009311_t7/?tag_id=28" target="_blank">第二单元 化学能与电能的转化精品练习题</a>,文件包含122化学能与电能的转化化学电源分层练习原卷版docx、122化学能与电能的转化化学电源解析版docx等2份试卷配套教学资源,其中试卷共26页, 欢迎下载使用。
人教版 (2019)选择性必修1第二节 化学平衡课堂检测: 这是一份人教版 (2019)选择性必修1<a href="/hx/tb_c4002420_t7/?tag_id=28" target="_blank">第二节 化学平衡课堂检测</a>,文件包含222影响化学平衡状态的因素知识解读教师版2024-2025学年高二化学同步教学知识解读与分层特训人教版2019选择性必修1pdf、222影响化学平衡状态的因素知识解读学生版2024-2025学年高二化学同步教学知识解读与分层特训人教版2019选择性必修1pdf等2份试卷配套教学资源,其中试卷共31页, 欢迎下载使用。













