






高中化学苏教版 (2019)选择性必修1第二单元 化学反应的方向与限度一等奖课件ppt
展开对恒温、恒压条件下的可逆反应,用压强平衡常数分析解决问题往往比较简单。1.分压(1)定义:相同温度下,当某组分气体B单独存在且具有与混合气体总体积相同体积时,该气体B所具有的压强,称为气体B的分压强。(2)计算公式:混合气体中某组分的分压=总压×该组分的物质的量分数,pB=p总×(3)分压定律:混合气体的总压等于相同温度下各组分气体的分压之和,即p总=pA+pB+pC+…
2.压强平衡常数一定温度下,气相反应mA(g)+nB(g) eC(g)+fD(g)达平衡时,气态生成物分压幂之积与气态反应物分压幂之积的比值为一个常数,称为该反应的压强平衡常数,用符号Kp表示,Kp的表达式如右:Kp=3.运用计算技巧压强平衡常数计算技巧:第一步,根据“三段式”法计算平衡体系中各物质的物质的量或物质的量浓度。第二步,计算各气体组分的物质的量分数或体积分数。
第三步,根据分压计算公式求出各气体物质的分压,某气体的分压=气体总压强×该气体的体积分数(或物质的量分数)。第四步,根据平衡常数计算公式代入计算,例如:N2(g)+3H2(g) 2NH3(g),压强平衡常数表达式为Kp=
1.(2021·金华检测)已知2NO2(g) N2O4(g)用分压p(其组分的分压等于总压与其物质的量分数的积)表示的平衡常数Kp= 。298 K时,在体积固定的密闭容器中充入一定量的NO2,平衡时NO2的分压为100 kPa。已知Kp=2.7×10-3kPa-1,则NO2的转化率为A.70% B.55%C.46% D.35%
假设NO2起始时投入的物质的量为1 ml,平衡转化率为x,用三段式法计算:2NO2(g) N2O4(g)起始/ml 1 0改变/ml x 0.5x平衡/ml 1-x 0.5x同温同体积时,压强之比等于物质的量之比,则p(NO2)∶p(N2O4)=(1-x)∶0.5x=100 kPa∶p(N2O4),
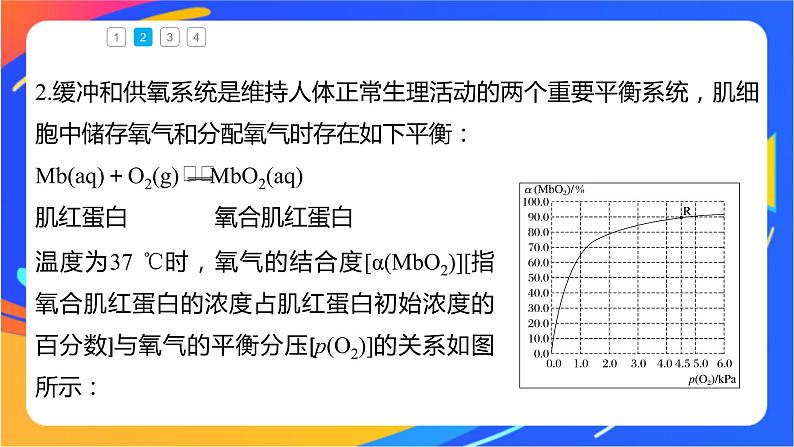
2.缓冲和供氧系统是维持人体正常生理活动的两个重要平衡系统,肌细胞中储存氧气和分配氧气时存在如下平衡:Mb(aq)+O2(g) MbO2(aq)肌红蛋白 氧合肌红蛋白
温度为37 ℃时,氧气的结合度[α(MbO2)][指氧合肌红蛋白的浓度占肌红蛋白初始浓度的百分数]与氧气的平衡分压[p(O2)]的关系如图所示:
回答下列问题:(1)利用R点所示数据,计算37 ℃时该反应的平衡常数K=_________(氧气的平衡浓度可用氧气的平衡分压代替求算)。
(2)已知37 ℃时,该反应的正反应速率v正=k1c(Mb)·p(O2),逆反应速率v逆=k2c(MbO2),k1、k2分别是正、逆反应速率常数,若k2=60 s-1,则k1=_______________。
120 s-1·kPa-1
37 ℃反应达到平衡时,v正=v逆,则k1c(Mb)·p(O2)=k2c(MbO2),k1= =60 s-1×2.0 kPa-1=120 s-1·kPa-1。
3.汽车尾气是造成雾霾天气的重要原因之一,尾气中的主要污染物为CxHy、NO、CO、SO2及固体颗粒物等。活性炭可用于处理汽车尾气中的NO,在1 L恒容密闭容器中加入 0.100 0 ml NO 和2.030 ml固体活性炭,生成A、B两种气体,在200 ℃下测得平衡体系中各物质的物质的量以及容器内压强如下表:
根据上表数据,写出容器中发生反应的化学方程式:___________________,计算反应体系在200 ℃时的平衡常数Kp=_____(用平衡分压代替平衡浓度计算,分压=总压×体积分数)。
1 L恒容密闭容器中加入0.100 0 ml NO和2.030 ml 固体活性炭,生成A、B两种气体,从表中数据可以看出:Δn(C)∶Δn(NO)∶Δn(A)∶Δn(B)=1∶2∶1∶1,可以推断出生成的A、B两种气体分别为N2和CO2,反应的化学方程式为C+2NO N2+CO2。该反应的平衡常数Kp= ,容器的体积为1 L,平衡分压之比等于平衡浓度之比,带入表中数据计算得Kp= 。
4.乙酸甲酯是树脂、涂料、油墨、油漆、胶粘剂、皮革生产过程所需的有机溶剂,而且乙酸甲酯还可作为原料制备燃料乙醇。在刚性容器压强为1.01 MPa时,乙酸甲酯与氢气制备乙醇主要发生如下反应:CH3COOCH3(g)+2H2(g) CH3OH(g)+CH3CH2OH(g)一定温度下,以n(CH3COOCH3)∶n(H2)=1∶10的投料比进行反应,乙酸甲酯转化率与气体总压强的关系如图所示:
(1)A点时,CH3COOCH3(g)的平衡分压为__________,CH3CH2OH(g)的体积分数为______%(保留一位小数)。
由图可看出,转化率为90%时,总压为1.01 MPa,已知n(CH3COOCH3)∶n(H2)=1∶10,列三段式求解:
CH3COOCH3(g)+2H2(g) CH3OH(g)+CH3CH2OH(g)初始/ml 1 10 0 0反应/ml 0.9 1.8 0.9 0.9平衡/ml 0.1 8.2 0.9 0.9
总压为1.01 MPa,因此CH3COOCH3(g)的平衡分压为1.01 MPa× =0.01 MPa;CH3CH2OH(g)的体积分数即为物质的量分数,其体积分数为 ×100%≈8.9%。
高中化学苏教版 (2019)选择性必修1第二单元 化学反应的方向与限度授课ppt课件: 这是一份高中化学苏教版 (2019)选择性必修1第二单元 化学反应的方向与限度授课ppt课件,共8页。
高中化学苏教版 (2019)选择性必修1第二单元 化学反应的方向与限度作业课件ppt: 这是一份高中化学苏教版 (2019)选择性必修1第二单元 化学反应的方向与限度作业课件ppt,共7页。
鲁科版 (2019)选择性必修1第1节 化学反应的方向备课课件ppt: 这是一份鲁科版 (2019)选择性必修1第1节 化学反应的方向备课课件ppt,共34页。PPT课件主要包含了素养目标,02MPa等内容,欢迎下载使用。













