




2024山东中考化学二轮专题复习 专题八 常见的化学计算(课件)
展开一、直接读取纯净物的质量(日照3考、潍坊2考)例1 向一定量的氯化铁溶液中加入50 g氢氧化钠溶液,二者恰好完全反应,过滤后将沉淀洗涤、干燥、称量,得到 10.7 g固体。求所用氢氧化钠溶液的溶质质量分数时,直接代入化学方程式中的纯净物是________(填物质名称,后同),质量为______。
寻找代入化学方程式的纯净物质量
例2 过氧化氢溶液长期保存会自然分解,使得溶液溶质质量分数减小。小军从家中拿来一瓶久置的医用过氧化氢溶液,和同学们一起测定溶质质量分数。他们取出该溶液 51 g,加入适量二氧化锰,生成气体的质量与反应时间的关系如图所示。计算该溶液中溶质的质量分数时,需代入化学方程式中的纯净物为_____,质量为______。
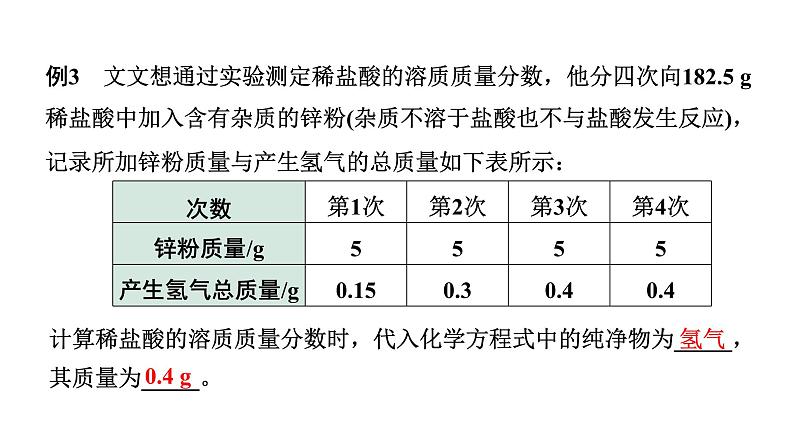
例3 文文想通过实验测定稀盐酸的溶质质量分数,他分四次向182.5 g稀盐酸中加入含有杂质的锌粉(杂质不溶于盐酸也不与盐酸发生反应),记录所加锌粉质量与产生氢气的总质量如下表所示:
计算稀盐酸的溶质质量分数时,代入化学方程式中的纯净物为_____,其质量为_____。
二、利用质量差计算纯净物的质量(日照2017.17;潍坊2考)例4 镁铜合金常用作飞机天线等导电材料,现取某镁铜合金 10 g放入烧杯中,加入足量稀硫酸充分反应后,测得剩余固体的质量为 6.4 g,求生成氢气的质量时,直接代入化学方程式中的纯净物为___,质量为________________(写出计算式和结果,下同)。
10 g-6.4 g=3.6 g
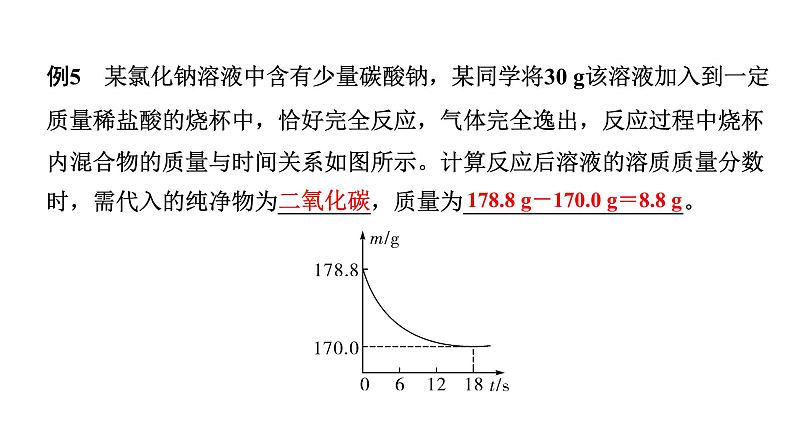
例5 某氯化钠溶液中含有少量碳酸钠,某同学将30 g该溶液加入到一定质量稀盐酸的烧杯中,恰好完全反应,气体完全逸出,反应过程中烧杯内混合物的质量与时间关系如图所示。计算反应后溶液的溶质质量分数时,需代入的纯净物为________,质量为___________________。
178.8 g-170.0 g=8.8 g
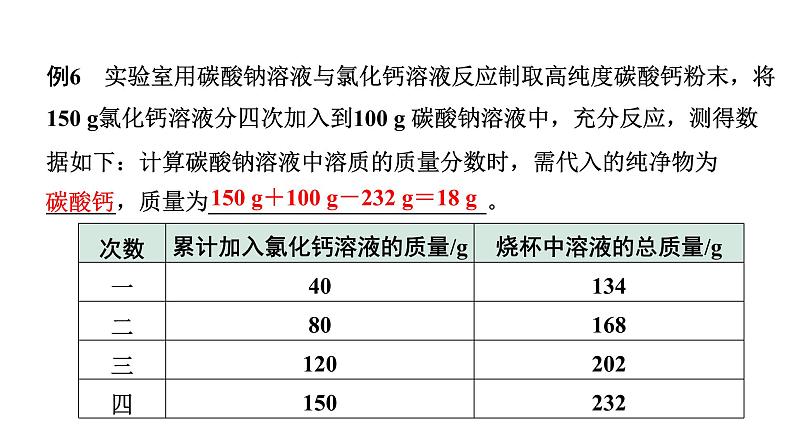
例6 实验室用碳酸钠溶液与氯化钙溶液反应制取高纯度碳酸钙粉末,将150 g氯化钙溶液分四次加入到100 g 碳酸钠溶液中,充分反应,测得数据如下:计算碳酸钠溶液中溶质的质量分数时,需代入的纯净物为______,质量为________________________。
150 g+100 g-232 g=18 g
三、利用质量分数计算纯净物的质量(潍坊2017.21)例7 某工厂采购了一批400 t含氢氧化钠 70%的烧碱样品(其他杂质不与SO2反应),计划将这批烧碱制成氢氧化钠溶液来吸收二氧化硫。计算可吸收二氧化硫的质量时,需代入的纯净物为________,质量为_________________。
400 t×70%=280 t
例8 欲测定一瓶标签破损的稀硫酸的溶质质量分数,现取30 g该稀硫酸样品于烧杯中,将15%的NaOH溶液逐滴滴入烧杯中,边加边搅拌,随着NaOH溶液的不断滴入,溶液pH的变化如图所示。则测定稀硫酸的质量分数时,需代入的纯净物为________,其质量为________________。
8 g×15%=1.2 g
(以计算加热24.5 g KClO3至完全分解可以得到氧气的质量为例)
将纯净物的质量代入化学方程式中计算求解
根据计算出的质量求质量分数
1. 我国是现代湿法冶金术的先驱,早在西汉时期,就有“曾青得铁则化为铜”的记载,利用此原理从硫酸铜的废液中回收金属铜,向100 g的废液中加入足量的铁粉,得到铜的质量为1.28 g。(1)计算废液中硫酸铜的质量分数是多少?(2)根据以上原理分析______(填“能”或“不能”)用铁制容器配制农药波尔多液。
废液中硫酸铜的质量分数为 ×100%=3.2%答:废液中硫酸铜的质量分数为3.2%。
2. 某化学兴趣小组的同学为测定某稀盐酸的溶质质量分数,取50 g稀盐酸倒入烧杯中,加入一定量的硝酸银溶液边加边搅拌至不再产生沉淀,得到105.83 g混合物。将上述混合物过滤后得到77.13 g滤液(假设过滤过程中滤液没有损耗)。(1)反应生成沉淀的质量为________g。(2)该稀盐酸的溶质质量分数是多少?(3)向反应后的滤液中滴入紫色石蕊溶液后,溶液呈____色。
3. 为清洗废旧黑色铜丝(只含铜和氧化铜),某工厂实验室设计了如下方案,取30 g黑色铜丝,向其中加入100 g溶质质量分数为7.3%的稀盐酸,恰好完全反应。(1)反应后的溶液呈________色。(2)清洗后的铜丝的质量为多少?(3)计算反应后溶液中溶质的质量分数。
4. 某化工产品的成分是碳酸钙、氢氧化钙和硫酸钡,现取该化工产品样品20 g放入锥形瓶内,向其中加适量水,振荡,然后再向锥形瓶中滴加溶质质量分数为10%的稀盐酸,反应生成二氧化碳的质量与加入稀盐酸的质量关系如图所示。请回答下列问题:(1)该样品中钙元素的质量分数是________(只填空,不列式计算)。(2)计算该样品中氢氧化钙的质量。
坐标曲线型(日照3考;潍坊2考)
5. 工业上,高温煅烧石灰石可制得氧化钙和二氧化碳。现用10 t含杂质的石灰石生产氧化钙,剩余固体质量与反应时间的关系如图所示(杂质不参加反应),请计算:(1)生成氧化钙的质量。(2)该石灰石的纯度为______。
6. 为探究铜及其化合物的性质,进行如下实验:称取部分已被H2还原的氧化铜粉末(含Cu和CuO)7.2 g置于烧杯中,向其中加入50 g稀硫酸,充分反应后,再向烧杯中加入溶质质量分数为20%的NaOH溶液,加NaOH溶液的过程中,烧杯内固体物质的质量与加入NaOH溶液的质量关系如图所示。
请计算:(1)Cu和CuO的混合物中,Cu元素和O元素的质量比(写出计算过程,下同)。(2)实验所用稀硫酸中溶质的质量分数。(3)a的值。
7. “盐酸-硫化钡法”生产的BaCl2溶液中常会混有盐酸,为了测定该溶液中BaCl2的溶质质量分数,某同学做了如下实验:取该产品液10.0 g于烧杯中,逐滴滴入质量分数为5.3%的Na2CO3溶液至过量。记录滴入Na2CO3溶液的质量与产生沉淀的质量变化关系如图所示:(1)与氯化钡反应时消耗碳酸钠的质量为_____g,图中n=________。(2)计算该溶液中BaCl2的质量分数(写出计算过程)。
(3)根据实验在图中画出加入碳酸钠溶液与产生气体的质量关系图。
(1)2.12 3.94(2)解:设10.0 g该溶液中氯化钡的质量为xBaCl2+Na2CO3=== BaCO3↓ + 2NaCl 208 106 x 2.12 g x=4.16 g该溶液中氯化钡的质量分数为 ×100%=41.6%答:该溶液中氯化钡的质量分数为41.6%。
8. 为测定某氢氧化钡溶液中溶质的质量分数,取一定量氢氧化钡溶液于烧杯中,逐渐加入碳酸钠溶液至过量,实验中测得的各项数据如下表所示。请计算:
表格型(日照、潍坊均2考)
(1)反应后生成沉淀的质量为________g。(2)氢氧化钡溶液中溶质的质量分数。
9. 某工厂生产的NaCl产品中含有杂质MgCl2,化学兴趣小组取100 g样品完全溶解于313.6 g水中,向该溶液中分5次加入一定浓度的氢氧化钠溶液,每次30 g,充分反应。测得实验数据如下表所示:
请完成下列各题:(1)样品中MgCl2的质量是________g。(2)计算恰好完全反应时所得溶液的溶质质量分数(写出规范的计算过程)。(3)请画出生成沉淀与加入氢氧化钠溶液质量的变化关系图(标明恰好完全反应时的坐标)。
(1)19(2)解:设生成氯化钠的质量为xMgCl2+2NaOH===Mg(OH)2↓+2NaCl 58 117 11.6 g x x=23.4 g第4次加入NaOH溶液后恰好完全反应。反应后所得溶液中溶质质量为100 g-19 g+23.4 g=104.4 g 反应后所得溶液的质量为100 g+313.6 g+4×30 g-11.6 g=522 g
反应后所得溶液的溶质质量分数为 ×100%=20%答:恰好完全反应时所得溶液溶质的质量分数为20%。
10. 某小组同学进行了如图的实验,请计算:(1)生成氢气的质量是________g。(2)反应后所得溶液中溶质质量分数(写出计算过程)。
11.请根据所示的实验过程和提供的信息作答:(1)实验结束后溶液中的溶质为______________。(2)实验所用K2CO3溶液的溶质质量分数为______(精确至0.1%)。(3)计算原混合液中CaCl2的质量分数(写出计算过程,精确至0.1%)。
12. 某化学兴趣小组的同学利用压强传感器、数据采集器和计算机等数字化实验设备,测定铝片与足量浓度为9.8%的稀硫酸反应时气体压强的变化,实验结果如图所示:
(1)开始一段时间气体压强不变,其原因是________________________。(2)计算铝片中氧化铝的质量。(3)在图中画出加入40 g稀硫酸与铝片反应产生气体的质量的关系图。
2024山东中考化学二轮专题复习 微专题 化学用语(课件): 这是一份2024山东中考化学二轮专题复习 微专题 化学用语(课件),共23页。PPT课件主要包含了Na+,Ca2+,Fe3+,Fe2+,Mg2+,Zn2+,Al3+,Cl-,OH-,H2O等内容,欢迎下载使用。
2024山东中考化学二轮专题复习 微专题 常见气体的制取及净化(课件): 这是一份2024山东中考化学二轮专题复习 微专题 常见气体的制取及净化(课件),共37页。PPT课件主要包含了反应物状态,反应条件,塞一团棉花,可以控制反应速率,溶解性,瓶内的空气,移出导管,撤离酒精灯,排净集气,伸入集气瓶内等内容,欢迎下载使用。
2024辽宁中考化学二轮重点专题研究 专题八 常见的化学计算(课件): 这是一份2024辽宁中考化学二轮重点专题研究 专题八 常见的化学计算(课件),共35页。PPT课件主要包含了∶4∶1,有机物,∶12∶3等内容,欢迎下载使用。












