






还剩16页未读,
继续阅读
所属成套资源:全套鲁科版高中化学必修第一册课时课件
成套系列资料,整套一键下载
鲁科版高中化学必修第一册专题4一定物质的量浓度溶液的配制课件
展开
这是一份鲁科版高中化学必修第一册专题4一定物质的量浓度溶液的配制课件,共24页。
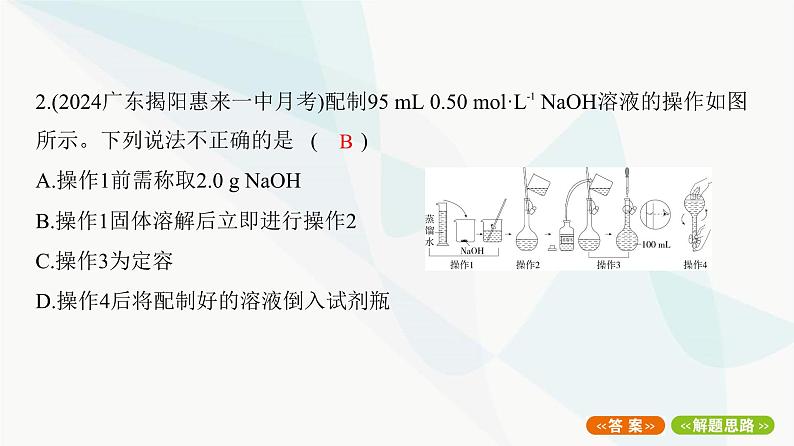
D解题思路 容量瓶不能用来稀释浓溶液和溶解固体,故A、B错误;溶液应冷却 至室温再转移到容量瓶中,故C错误;在向容量瓶中转移液体时,要用玻璃棒引流, 故D正确。B解题思路 配制题述溶液需用规格为100 mL的容量瓶,则应称取NaOH固体的 质量为0.50 mol·L-1×0.1 L×40 g·mol-1=2.0 g,故A正确;NaOH固体溶于水放热,则 溶解后需要冷却至室温再转移溶液至容量瓶中,故B错误;根据题图可知,操作3 为定容,故C正确;容量瓶不能用来长期储存溶液,则需要将配制好的溶液倒入试 剂瓶中,并贴好标签,故D正确。3.(2024河北唐山期中)实验室需要配制100 mL 3 mol·L-1稀硫酸,下列操作错误的 是 ( )A.量取18.4 mol·L-1的浓硫酸16.3 mLB.将稀释后的硫酸溶液沿容量瓶内壁缓缓注入容量瓶中C.用蒸馏水洗涤烧杯和玻璃棒,洗涤液转移至容量瓶中,重复操作2~3次D.使用胶头滴管定容B解题思路 要配制100 mL 3 mol·L-1稀硫酸,需18.4 mol·L-1的浓硫酸的体积为 ≈0.016 3 L=16.3 mL,故A正确;在移液操作中,需将稀释、冷却后的硫酸溶液沿玻璃棒缓缓注入容量瓶中,故B错误;为使量取的溶质全部转移到 容量瓶中,减少误差,需用蒸馏水洗涤烧杯和玻璃棒2~3次,并将洗涤液转移至容 量瓶中,故C正确;为保证实验精确度,定容时,需用胶头滴管向容量瓶中逐滴滴加 蒸馏水至溶液的凹液面与刻度线相切,故D正确。4.(2024云南大理下关一中月考创新改编)在配制一定物质的量浓度的溶液的过 程中,下列有关说法错误的是 ( )A.配制一定物质的量浓度的NaOH溶液时,将称量好的NaOH固体全部转移到容 量瓶中,加水溶解、冷却后再定容B.配制1 000 mL 0.2 mol/L的硫酸铜溶液时,需准确称量胆矾50.0 gC.配制一定物质的量浓度的溶液时,必须使用的仪器有烧杯、玻璃棒、容量瓶 (适当规格)、胶头滴管D.容量瓶摇匀后溶液液面低于刻度线,此时不用再滴加蒸馏水至刻度线A解题思路 容量瓶不能用来溶解固体和稀释浓溶液,否则会带来误差,故A错误; 配制1 000 mL 0.2 mol/L的CuSO4溶液时,称量胆矾(CuSO4·5H2O)的质量为1 L×0.2 mol/L×250 g/mol=50.0 g,故B正确;配制一定物质的量浓度的溶液时,必须使用 的仪器有烧杯、玻璃棒、容量瓶(适当规格)、胶头滴管,故C正确;摇匀时,由于 溶液会残留在容量瓶刻度线上方的内壁以及瓶塞部位,溶液液面会低于刻度线, 此时不用再滴加蒸馏水至刻度线,故D正确。5.(10分)(2024山东烟台期中)某品牌海藻加碘盐的产品说明如图。回答下列问题:(1)KIO3的电离方程式为 ;每袋海藻加碘盐中KIO3的物质 的量不超过 mol(保留两位有效数字)。(2)实验室需要460 mL 0.5 mol/L KIO3溶液,现用KIO3固体配制。①配制过程可分为两个阶段:阶段Ⅰ.用托盘天平称量 g KIO3固体。阶段Ⅱ.将称量的KIO3固体加适量蒸馏水溶解,然后将所得溶液转入 (填仪器名称)中,再经洗涤、定容、摇匀后即可得到0.5 mol/L KIO3溶液。下列 有关阶段Ⅱ的操作,错误的有 (填字母)。③取5 mL配制完成的KIO3溶液与10 mL 1.0 mol/L K2SO4溶液混合(忽略溶液体 积变化),所得混合液中c(K+)= mol/L。②若定容时俯视刻度线,所配溶液浓度将 (填“偏大”“偏小”或“无 影响”);若定容、摇匀后发现忘记洗涤烧杯,应进行的操作是 。答案 (除标注外,每空1分)(1)KIO3 K++I 1.2×10-4(2分)(2)①53.5 500 mL容量瓶 CD ②偏大 重新配制 ③1.5(2分)体积偏小,所配溶液浓度将偏大;若定容、摇匀后发现忘记洗涤烧杯,应重新配 制。③取5 mL配制完成的KIO3溶液与10 mL 1.0 mol/L K2SO4溶液混合(忽略溶 液体积变化),所得混合液中c(K+)= =1.5 mol/L。考向二 一定物质的量浓度溶液配制的 误差分析6.(2024江苏百校月考创新改编)某同学在配制100 mL 1 mol·L-1 NaOH溶液的系 列操作中导致所配溶液浓度偏低的是( )①选刚用蒸馏水洗净的100 mL容量瓶进行配制 ②称量时,将固体NaOH放在垫了白纸的托盘天平左盘上 ③称量固体时砝码生锈了 ④用蒸馏水洗涤烧杯内壁和玻璃棒两次,洗涤液都移入容量瓶中 ⑤定容时仰视刻度线⑥由于不慎,液面超过容量瓶刻度线,直接用胶头滴管吸出超过的一部分C⑦摇匀时,部分溶液洒落,又加水补至溶液凹液面与刻度线相切A.仅①④ B.仅①④⑤ C.仅②⑤⑥⑦ D.仅②⑥⑦解题思路 ①选刚用蒸馏水洗净的100 mL容量瓶进行配制,对溶液浓度无影响, 不符合题意;②氢氧化钠易潮解,将固体NaOH放在垫了白纸的托盘天平左盘上, 部分氢氧化钠会残留在纸上,使溶液中溶质偏少,所配溶液浓度偏低,符合题意; ③砝码生锈,会导致所称NaOH固体增多,则所配溶液浓度偏高,不符合题意;④用 蒸馏水洗涤烧杯内壁和玻璃棒两次,洗涤液都移入容量瓶中,对溶液浓度无影 响,不符合题意;⑤定容时仰视刻度线,使溶液体积偏大,则所配溶液浓度偏低,符 合题意;⑥液面超过容量瓶刻度线,直接用胶头滴管吸出超过的一部分,使所配 溶液浓度偏低,符合题意;⑦摇匀时,部分溶液洒落,又加水补至溶液凹液面与刻度线相切,使所配溶液浓度偏低,符合题意;综上,导致所配溶液浓度偏低的是② ⑤⑥⑦,故选C。D8.(12分)(2024山东枣庄期中创新改编)某学校化学兴趣小组需要使用400 mL 0.1 mol·L-1 NaOH溶液,配制时:(1)需称取NaOH固体 g。(2)溶解NaOH固体和将NaOH溶液转移至容量瓶时都用到了玻璃棒,前者玻璃棒 的作用是 ,后者玻璃棒的作用是 。(3)实验室配制上述溶液有下列图示操作:(4)配制NaOH溶液时,下列操作会导致溶液的浓度偏低的是 (填字母)。A.称取NaOH固体时动作缓慢B.NaOH溶液转移至容量瓶后,没有洗涤烧杯和玻璃棒C.称取的NaOH固体中含有少量Na2OD.定容、摇匀后,转移至刚刚用蒸馏水洗净的试剂瓶中ⅰ.配制操作的正确顺序为 。ⅱ.不规范的操作为 (填字母)。a.①② b.②③ c.②④ d.⑤⑥答案 (每空2分)(1)2.0 (2)搅拌、加速溶解 引流(3)ⅰ.①④③⑥②⑤ ⅱ.a (4)ABD解题思路 (1)需要400 mL 0.1 mol·L-1 NaOH溶液,配制时应选用500 mL容量瓶, 则需称取NaOH固体的质量为0.1 mol·L-1×0.5 L×40 g·mol-1=2.0 g。(2)溶解NaOH固体时,玻璃棒的作用是搅拌、加速溶解;将NaOH溶液转移至容 量瓶时,玻璃棒的作用是引流。(3)ⅰ.一定物质的量浓度溶液的配制,操作步骤为计算、称量或量取、溶解或稀 释、转移、洗涤、定容、摇匀、装瓶贴标签,则正确顺序为①④③⑥②⑤。ⅱ. ①中NaOH固体应放在烧杯中称量,②中用胶头滴管加水时应竖直悬空,不能伸 入瓶内,故选a。(4)NaOH固体易潮解,吸水后称量的NaOH固体质量少,称取NaOH固体时动作缓 慢,会导致溶液的浓度偏低,故A符合题意;NaOH溶液转移至容量瓶后,没有洗涤 烧杯和玻璃棒,导致溶质物质的量减小,溶液浓度偏低,故B符合题意;称取的 NaOH固体中含有少量Na2O,Na2O会与水反应生成NaOH,导致溶质增多,溶液浓 度偏高,故C不符合题意;定容、摇匀后,转移至刚刚用蒸馏水洗净的试剂瓶中,则 溶液被稀释,浓度偏低,故D符合题意。
D解题思路 容量瓶不能用来稀释浓溶液和溶解固体,故A、B错误;溶液应冷却 至室温再转移到容量瓶中,故C错误;在向容量瓶中转移液体时,要用玻璃棒引流, 故D正确。B解题思路 配制题述溶液需用规格为100 mL的容量瓶,则应称取NaOH固体的 质量为0.50 mol·L-1×0.1 L×40 g·mol-1=2.0 g,故A正确;NaOH固体溶于水放热,则 溶解后需要冷却至室温再转移溶液至容量瓶中,故B错误;根据题图可知,操作3 为定容,故C正确;容量瓶不能用来长期储存溶液,则需要将配制好的溶液倒入试 剂瓶中,并贴好标签,故D正确。3.(2024河北唐山期中)实验室需要配制100 mL 3 mol·L-1稀硫酸,下列操作错误的 是 ( )A.量取18.4 mol·L-1的浓硫酸16.3 mLB.将稀释后的硫酸溶液沿容量瓶内壁缓缓注入容量瓶中C.用蒸馏水洗涤烧杯和玻璃棒,洗涤液转移至容量瓶中,重复操作2~3次D.使用胶头滴管定容B解题思路 要配制100 mL 3 mol·L-1稀硫酸,需18.4 mol·L-1的浓硫酸的体积为 ≈0.016 3 L=16.3 mL,故A正确;在移液操作中,需将稀释、冷却后的硫酸溶液沿玻璃棒缓缓注入容量瓶中,故B错误;为使量取的溶质全部转移到 容量瓶中,减少误差,需用蒸馏水洗涤烧杯和玻璃棒2~3次,并将洗涤液转移至容 量瓶中,故C正确;为保证实验精确度,定容时,需用胶头滴管向容量瓶中逐滴滴加 蒸馏水至溶液的凹液面与刻度线相切,故D正确。4.(2024云南大理下关一中月考创新改编)在配制一定物质的量浓度的溶液的过 程中,下列有关说法错误的是 ( )A.配制一定物质的量浓度的NaOH溶液时,将称量好的NaOH固体全部转移到容 量瓶中,加水溶解、冷却后再定容B.配制1 000 mL 0.2 mol/L的硫酸铜溶液时,需准确称量胆矾50.0 gC.配制一定物质的量浓度的溶液时,必须使用的仪器有烧杯、玻璃棒、容量瓶 (适当规格)、胶头滴管D.容量瓶摇匀后溶液液面低于刻度线,此时不用再滴加蒸馏水至刻度线A解题思路 容量瓶不能用来溶解固体和稀释浓溶液,否则会带来误差,故A错误; 配制1 000 mL 0.2 mol/L的CuSO4溶液时,称量胆矾(CuSO4·5H2O)的质量为1 L×0.2 mol/L×250 g/mol=50.0 g,故B正确;配制一定物质的量浓度的溶液时,必须使用 的仪器有烧杯、玻璃棒、容量瓶(适当规格)、胶头滴管,故C正确;摇匀时,由于 溶液会残留在容量瓶刻度线上方的内壁以及瓶塞部位,溶液液面会低于刻度线, 此时不用再滴加蒸馏水至刻度线,故D正确。5.(10分)(2024山东烟台期中)某品牌海藻加碘盐的产品说明如图。回答下列问题:(1)KIO3的电离方程式为 ;每袋海藻加碘盐中KIO3的物质 的量不超过 mol(保留两位有效数字)。(2)实验室需要460 mL 0.5 mol/L KIO3溶液,现用KIO3固体配制。①配制过程可分为两个阶段:阶段Ⅰ.用托盘天平称量 g KIO3固体。阶段Ⅱ.将称量的KIO3固体加适量蒸馏水溶解,然后将所得溶液转入 (填仪器名称)中,再经洗涤、定容、摇匀后即可得到0.5 mol/L KIO3溶液。下列 有关阶段Ⅱ的操作,错误的有 (填字母)。③取5 mL配制完成的KIO3溶液与10 mL 1.0 mol/L K2SO4溶液混合(忽略溶液体 积变化),所得混合液中c(K+)= mol/L。②若定容时俯视刻度线,所配溶液浓度将 (填“偏大”“偏小”或“无 影响”);若定容、摇匀后发现忘记洗涤烧杯,应进行的操作是 。答案 (除标注外,每空1分)(1)KIO3 K++I 1.2×10-4(2分)(2)①53.5 500 mL容量瓶 CD ②偏大 重新配制 ③1.5(2分)体积偏小,所配溶液浓度将偏大;若定容、摇匀后发现忘记洗涤烧杯,应重新配 制。③取5 mL配制完成的KIO3溶液与10 mL 1.0 mol/L K2SO4溶液混合(忽略溶 液体积变化),所得混合液中c(K+)= =1.5 mol/L。考向二 一定物质的量浓度溶液配制的 误差分析6.(2024江苏百校月考创新改编)某同学在配制100 mL 1 mol·L-1 NaOH溶液的系 列操作中导致所配溶液浓度偏低的是( )①选刚用蒸馏水洗净的100 mL容量瓶进行配制 ②称量时,将固体NaOH放在垫了白纸的托盘天平左盘上 ③称量固体时砝码生锈了 ④用蒸馏水洗涤烧杯内壁和玻璃棒两次,洗涤液都移入容量瓶中 ⑤定容时仰视刻度线⑥由于不慎,液面超过容量瓶刻度线,直接用胶头滴管吸出超过的一部分C⑦摇匀时,部分溶液洒落,又加水补至溶液凹液面与刻度线相切A.仅①④ B.仅①④⑤ C.仅②⑤⑥⑦ D.仅②⑥⑦解题思路 ①选刚用蒸馏水洗净的100 mL容量瓶进行配制,对溶液浓度无影响, 不符合题意;②氢氧化钠易潮解,将固体NaOH放在垫了白纸的托盘天平左盘上, 部分氢氧化钠会残留在纸上,使溶液中溶质偏少,所配溶液浓度偏低,符合题意; ③砝码生锈,会导致所称NaOH固体增多,则所配溶液浓度偏高,不符合题意;④用 蒸馏水洗涤烧杯内壁和玻璃棒两次,洗涤液都移入容量瓶中,对溶液浓度无影 响,不符合题意;⑤定容时仰视刻度线,使溶液体积偏大,则所配溶液浓度偏低,符 合题意;⑥液面超过容量瓶刻度线,直接用胶头滴管吸出超过的一部分,使所配 溶液浓度偏低,符合题意;⑦摇匀时,部分溶液洒落,又加水补至溶液凹液面与刻度线相切,使所配溶液浓度偏低,符合题意;综上,导致所配溶液浓度偏低的是② ⑤⑥⑦,故选C。D8.(12分)(2024山东枣庄期中创新改编)某学校化学兴趣小组需要使用400 mL 0.1 mol·L-1 NaOH溶液,配制时:(1)需称取NaOH固体 g。(2)溶解NaOH固体和将NaOH溶液转移至容量瓶时都用到了玻璃棒,前者玻璃棒 的作用是 ,后者玻璃棒的作用是 。(3)实验室配制上述溶液有下列图示操作:(4)配制NaOH溶液时,下列操作会导致溶液的浓度偏低的是 (填字母)。A.称取NaOH固体时动作缓慢B.NaOH溶液转移至容量瓶后,没有洗涤烧杯和玻璃棒C.称取的NaOH固体中含有少量Na2OD.定容、摇匀后,转移至刚刚用蒸馏水洗净的试剂瓶中ⅰ.配制操作的正确顺序为 。ⅱ.不规范的操作为 (填字母)。a.①② b.②③ c.②④ d.⑤⑥答案 (每空2分)(1)2.0 (2)搅拌、加速溶解 引流(3)ⅰ.①④③⑥②⑤ ⅱ.a (4)ABD解题思路 (1)需要400 mL 0.1 mol·L-1 NaOH溶液,配制时应选用500 mL容量瓶, 则需称取NaOH固体的质量为0.1 mol·L-1×0.5 L×40 g·mol-1=2.0 g。(2)溶解NaOH固体时,玻璃棒的作用是搅拌、加速溶解;将NaOH溶液转移至容 量瓶时,玻璃棒的作用是引流。(3)ⅰ.一定物质的量浓度溶液的配制,操作步骤为计算、称量或量取、溶解或稀 释、转移、洗涤、定容、摇匀、装瓶贴标签,则正确顺序为①④③⑥②⑤。ⅱ. ①中NaOH固体应放在烧杯中称量,②中用胶头滴管加水时应竖直悬空,不能伸 入瓶内,故选a。(4)NaOH固体易潮解,吸水后称量的NaOH固体质量少,称取NaOH固体时动作缓 慢,会导致溶液的浓度偏低,故A符合题意;NaOH溶液转移至容量瓶后,没有洗涤 烧杯和玻璃棒,导致溶质物质的量减小,溶液浓度偏低,故B符合题意;称取的 NaOH固体中含有少量Na2O,Na2O会与水反应生成NaOH,导致溶质增多,溶液浓 度偏高,故C不符合题意;定容、摇匀后,转移至刚刚用蒸馏水洗净的试剂瓶中,则 溶液被稀释,浓度偏低,故D符合题意。
相关资料
更多









