





还剩15页未读,
继续阅读
所属成套资源:人教版化学九年级下册 第八单元课教学课件
成套系列资料,整套一键下载
人教版化学九年级下册 第十一单元课题1第三课时 物质的分类、盐的化学性质课件
展开
这是一份人教版化学九年级下册 第十一单元课题1第三课时 物质的分类、盐的化学性质课件,共23页。
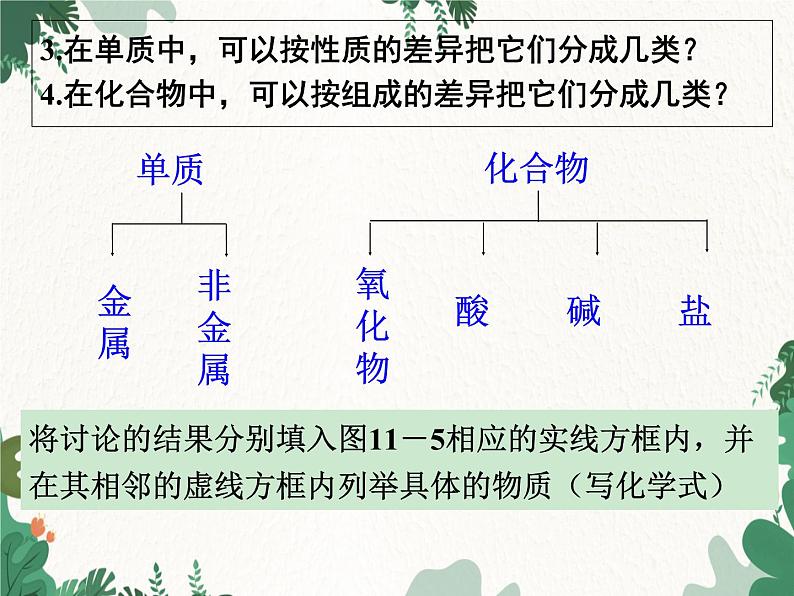
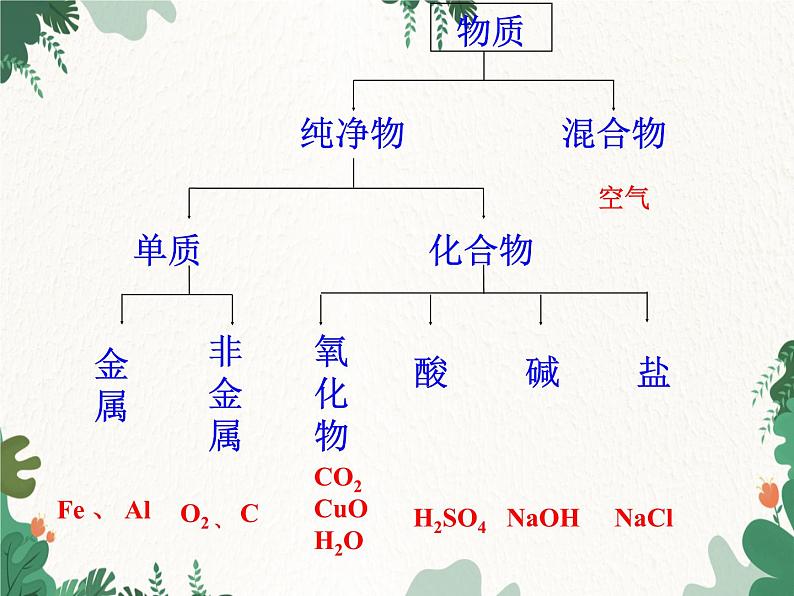
化学九年级下册 RJ 第 十一 单元 盐 化肥课题1 生活中常见的盐第3课时 物质分类、盐的化学性质 迄今为止,在初中化学中,我们已经学习了关于空气、氧气、水、碳、二氧化碳、氧化铜、铁、铝、硫酸、氢氧化钠和氯化钠等一系列物质的知识。为方便记忆和进一步学习,我们应该对学过的物质进行整理和分类。讨论新课导入 1.根据物质组成是否单一,可以把物质分成几类? 2.在纯净物中,根据组成元素的异同,可以把它们 分成几类?两类。纯净物和混合物。两类。单质和化合物。化合物单质纯净物混合物物质 可按组成和性质对学过的物质进行整理和分类,例如:新课推进3.在单质中,可以按性质的差异把它们分成几类?4.在化合物中,可以按组成的差异把它们分成几类?将讨论的结果分别填入图11-5相应的实线方框内,并在其相邻的虚线方框内列举具体的物质(写化学式)非金属金属单质盐碱酸氧化物化合物NaClNaOHH2SO4CO2 CuOH2OO2 、 CFe 、 Al盐碱酸氧化物非金属金属空气化合物单质纯净物混合物 上一单元我们学习酸、碱的性质时,发现并归纳出了酸、碱的通性,那么盐是否也有相似的化学性质呢?提出问题盐的化学性质有:1.盐+金属→盐+金属如:Fe+CuSO4=Cu+FeSO4 Cu+2AgNO3=2Ag+Cu(NO3)2反应必须满足的条件:①参加反应的盐必须溶于水;②“前换后”(或说“强换弱”):即在金属活动性顺序表中,排在前面的金属能把排在后面的金属从其盐溶液中置换出来。③K、Ca、Na在盐溶液中一般先容易与水反应。归纳总结2.盐+酸→盐+酸条件:满足复分解反应的条件即可;(1)只能强酸制弱酸;(2)如果反应物和生成物中的酸性相近,则生成物中必须有沉淀。例:CaCO3+2HCl =CaCl2+H2O+CO2↑(正) HCl+AgNO3 = AgCl↓+HNO3(正) H2CO3+CaCl2 = CaCO3↓+2HCl(误) Na2SO4+2HCl = 2NaCl+H2SO4(误) 3.盐+碱→盐+碱条件:①反应物必须都溶于水;②生成物满足复分解反应的条件即可;例:2NaOH+CuSO4=Cu(OH)2↓+Na2SO4(正)NaOH+KCl = NaCl+KOH(误) 例:BaCl2+Na2SO4=BaSO4↓+2NaCl(正)BaCO3+Na2SO4=BaSO4↓+Na2CO3(误)4.盐+盐→盐+盐条件:①反应物必须都溶于水;②生成物满足复分解反应的条件即可。 依据盐的化学性质及反应条件,判断下列反应能否发生?能的请完成化学方程式,并说明理由。 ⑴Zn+CuCl2— ⑵Fe+AgCl — ⑶K+CuSO4 — ⑷MgCl2+Zn — ⑸BaCl2+HNO3 — ⑹ BaCl2+H2SO4 — ⑺AgNO3+HCl — ⑻K2CO3+HCl — ⑼ BaCl2+KOH — ⑽Mg(OH)2+CuCl2 — ⑾NaOH+CuSO4 — ⑿ K2CO3+Ca(OH)2 — ⒀BaCl2+Na2CO3— ⒁CaCO3+Ba(NO3)2 —练一练1.如图是小宇对常见化合物的分类整理。(1)甲处应填写的物质类别是________;(2)小宇的分类整理中有一种物质归类错误,这种物质是________;(3)实验室现购进一批药品:铁粉、氧化铜、氢氧化镁、硫化钠、氯酸钾、醋酸,其中应归为盐类的是_____________。基本题型 物质的简单分类;常见的氧化物、酸、碱和盐的判别解析:无机化合物包括氧化物、酸碱盐等物质;C2H5OH属于有机化合物(第十二单元学习),不属于碱;由金属离子和酸根离子组成的化合物是盐。硫化钠、氯酸钾等物质是由金属离子和酸根离子组成的化合物,属于盐。氧化物C2H5OH硫化钠、氯酸钾随堂演练2.(2013·黑龙江大庆)下表是常见的几种酸、碱、盐在水溶液中解离出来离子的情况,根据表中信息分析,得出的结论正确的是( )A.在水溶液中能解离出H+的物质一定是酸B.在水溶液中解离出金属阳离子和酸根离子的物质一定是盐C.碱溶液中一定存在金属阳离子和OH-D.盐溶液中一定存在金属阳离子和酸根离子中考题型 酸、碱、盐的概念,物质的分类B解析:表中NaHSO4的物质类别属于盐,在水溶液中解离出来的离子有H+,但不属于酸,故A错误。根据盐的概念可知盐是由金属离子和酸根离子组成的化合物,与表中信息一致,则在水溶液中解离出金属阳离子和酸根离子的物质一定是盐,故B正确。由表中信息可知在氨水中解离出的离子为NH4+和OH-,则碱溶液解离出的离子一定有金属阳离子的说法错误,故C错误。在NH4Cl的盐溶液中解离出来的阳离子为NH4+ ,而不是金属阳离子,故D错误。 本节课我们学习了物质按不同组成、结构等进行分类的方法;盐的化学性质。课堂小结1.解释下述现象。(1)鸡蛋壳的主要成分是碳酸钙。将一个新鲜的鸡蛋放在盛有足量稀盐酸的玻璃杯中,可观察到鸡蛋一边冒气泡一边沉到杯底,一会儿又慢慢上浮,到接近液面时又下沉。解:1.(1)当鸡蛋放入盛有足量稀盐酸的玻璃杯中时,其主要成分碳酸钙就和盐酸反应生成二氧化碳气体,产生气泡。此时反应刚开始,鸡蛋的重力大于浮力,所以鸡蛋一边冒气泡一边沉到杯底;随着反应的进行,生成的二氧化碳气体附着在蛋壳表面上,浮力不断增大;当浮力大于重力时,鸡蛋慢慢上浮;当鸡蛋上浮到接近液面时,二氧化碳气体不断逸出进入空气中,使浮力小于重力,因此鸡蛋又下沉。如此不断循环反复,直至反应结束,鸡蛋沉入液面下。课后习题(2)馒头、面包等发面食品的一个特点是面团中有 许多小孔(如右图),它们使发面食品松软可口。根据发酵粉(含碳酸氢钠和有机酸等)可与面粉、水混合直接制作发面食品的事实,说明碳酸氢钠在其中的作用解:(2)NaHCO3和有机酸溶于水后,在蒸食品过程中生成CO2气体,使食品松软可口。2.通过一个阶段的化学学习,我们已经认识了许多物质,它们有的是单质,有的是氧化物,有的是酸、碱、盐。请用化学式各举几个例子。解答:开放性试题,举例如下:3.下列反应中不属于复分解反应的是( )A. H2SO4 + Ca(OH)2 = CaSO4 + 2H2OB. H2SO4 + BaCl2 = BaSO4↓ + 2HC1C. 2HC1 + Fe = FeCl2 + H2 ↑D. 2HC1 + CaCO3 = CaCl2 + CO2 ↑ +H2OC4.某同学发现,上个月做实验用的氢氧化钠溶液忘记了盖瓶盖。对于该溶液是否变质,同学们提出了如下假设:假设一:该溶液没有变质;假设二:该溶液部分变质;假设三:该溶液全部变质。请设计实验方案,分别验证以上假设,简要叙述实验步骤和现象,并写出相关反应的化学方程式。解:假设一:该溶液没有变质实验步骤:取少量该溶液于试管中,加入稀盐酸。实验现象:无气泡产生 化学方程式:NaOH+HCl==NaCl+H2O假设二:该溶液部分变质 实验步骤:取少量该溶液于试管中,加入过量氯化钙溶液,静置,取上层清液于另一支试管中,加入2~3滴酚酞溶液, 实验现象:有白色沉淀生成,上层清液变红 化学方程式:CaCl2+Na2CO3==2NaCl+CaCO3↓5.亚硝酸钠是一种工业用盐,它有毒、有咸味,外形与食盐相似。人若误食会引起 中毒,危害人体健康,甚至致人死亡。亚硝酸钠的水溶液呈碱性,食盐水溶液呈 中性。如果让你来鉴别亚硝酸钠和食盐,你选用什么试剂,如何操作?解:无色酚酞试液。操作:取少量盐溶于水中制成溶液,再加入2滴无色的酚酞,若溶液变红色,则原物质为亚硝酸钠;若溶液不变色,则原物质为食盐。6.氯化钠在生活、生产中的用途非常广泛。请通过查阅报纸、书刊、网络和访谈 等,了解氯化钠的用途,并以“氯化钠的妙用”为题编制资料卡片。解:氯化钠的妙用①医疗:生理盐水是0.9%的NaCl溶液;②农业生产:用氯化钠溶液选种;③生活:用食盐腌渍蔬菜、鱼、肉、蛋等;④交通:用氯化钠消除公路上的积雪;⑤化工生产:以NaCl为原料制取Na2CO3、NaOH、Cl2、盐酸等。
化学九年级下册 RJ 第 十一 单元 盐 化肥课题1 生活中常见的盐第3课时 物质分类、盐的化学性质 迄今为止,在初中化学中,我们已经学习了关于空气、氧气、水、碳、二氧化碳、氧化铜、铁、铝、硫酸、氢氧化钠和氯化钠等一系列物质的知识。为方便记忆和进一步学习,我们应该对学过的物质进行整理和分类。讨论新课导入 1.根据物质组成是否单一,可以把物质分成几类? 2.在纯净物中,根据组成元素的异同,可以把它们 分成几类?两类。纯净物和混合物。两类。单质和化合物。化合物单质纯净物混合物物质 可按组成和性质对学过的物质进行整理和分类,例如:新课推进3.在单质中,可以按性质的差异把它们分成几类?4.在化合物中,可以按组成的差异把它们分成几类?将讨论的结果分别填入图11-5相应的实线方框内,并在其相邻的虚线方框内列举具体的物质(写化学式)非金属金属单质盐碱酸氧化物化合物NaClNaOHH2SO4CO2 CuOH2OO2 、 CFe 、 Al盐碱酸氧化物非金属金属空气化合物单质纯净物混合物 上一单元我们学习酸、碱的性质时,发现并归纳出了酸、碱的通性,那么盐是否也有相似的化学性质呢?提出问题盐的化学性质有:1.盐+金属→盐+金属如:Fe+CuSO4=Cu+FeSO4 Cu+2AgNO3=2Ag+Cu(NO3)2反应必须满足的条件:①参加反应的盐必须溶于水;②“前换后”(或说“强换弱”):即在金属活动性顺序表中,排在前面的金属能把排在后面的金属从其盐溶液中置换出来。③K、Ca、Na在盐溶液中一般先容易与水反应。归纳总结2.盐+酸→盐+酸条件:满足复分解反应的条件即可;(1)只能强酸制弱酸;(2)如果反应物和生成物中的酸性相近,则生成物中必须有沉淀。例:CaCO3+2HCl =CaCl2+H2O+CO2↑(正) HCl+AgNO3 = AgCl↓+HNO3(正) H2CO3+CaCl2 = CaCO3↓+2HCl(误) Na2SO4+2HCl = 2NaCl+H2SO4(误) 3.盐+碱→盐+碱条件:①反应物必须都溶于水;②生成物满足复分解反应的条件即可;例:2NaOH+CuSO4=Cu(OH)2↓+Na2SO4(正)NaOH+KCl = NaCl+KOH(误) 例:BaCl2+Na2SO4=BaSO4↓+2NaCl(正)BaCO3+Na2SO4=BaSO4↓+Na2CO3(误)4.盐+盐→盐+盐条件:①反应物必须都溶于水;②生成物满足复分解反应的条件即可。 依据盐的化学性质及反应条件,判断下列反应能否发生?能的请完成化学方程式,并说明理由。 ⑴Zn+CuCl2— ⑵Fe+AgCl — ⑶K+CuSO4 — ⑷MgCl2+Zn — ⑸BaCl2+HNO3 — ⑹ BaCl2+H2SO4 — ⑺AgNO3+HCl — ⑻K2CO3+HCl — ⑼ BaCl2+KOH — ⑽Mg(OH)2+CuCl2 — ⑾NaOH+CuSO4 — ⑿ K2CO3+Ca(OH)2 — ⒀BaCl2+Na2CO3— ⒁CaCO3+Ba(NO3)2 —练一练1.如图是小宇对常见化合物的分类整理。(1)甲处应填写的物质类别是________;(2)小宇的分类整理中有一种物质归类错误,这种物质是________;(3)实验室现购进一批药品:铁粉、氧化铜、氢氧化镁、硫化钠、氯酸钾、醋酸,其中应归为盐类的是_____________。基本题型 物质的简单分类;常见的氧化物、酸、碱和盐的判别解析:无机化合物包括氧化物、酸碱盐等物质;C2H5OH属于有机化合物(第十二单元学习),不属于碱;由金属离子和酸根离子组成的化合物是盐。硫化钠、氯酸钾等物质是由金属离子和酸根离子组成的化合物,属于盐。氧化物C2H5OH硫化钠、氯酸钾随堂演练2.(2013·黑龙江大庆)下表是常见的几种酸、碱、盐在水溶液中解离出来离子的情况,根据表中信息分析,得出的结论正确的是( )A.在水溶液中能解离出H+的物质一定是酸B.在水溶液中解离出金属阳离子和酸根离子的物质一定是盐C.碱溶液中一定存在金属阳离子和OH-D.盐溶液中一定存在金属阳离子和酸根离子中考题型 酸、碱、盐的概念,物质的分类B解析:表中NaHSO4的物质类别属于盐,在水溶液中解离出来的离子有H+,但不属于酸,故A错误。根据盐的概念可知盐是由金属离子和酸根离子组成的化合物,与表中信息一致,则在水溶液中解离出金属阳离子和酸根离子的物质一定是盐,故B正确。由表中信息可知在氨水中解离出的离子为NH4+和OH-,则碱溶液解离出的离子一定有金属阳离子的说法错误,故C错误。在NH4Cl的盐溶液中解离出来的阳离子为NH4+ ,而不是金属阳离子,故D错误。 本节课我们学习了物质按不同组成、结构等进行分类的方法;盐的化学性质。课堂小结1.解释下述现象。(1)鸡蛋壳的主要成分是碳酸钙。将一个新鲜的鸡蛋放在盛有足量稀盐酸的玻璃杯中,可观察到鸡蛋一边冒气泡一边沉到杯底,一会儿又慢慢上浮,到接近液面时又下沉。解:1.(1)当鸡蛋放入盛有足量稀盐酸的玻璃杯中时,其主要成分碳酸钙就和盐酸反应生成二氧化碳气体,产生气泡。此时反应刚开始,鸡蛋的重力大于浮力,所以鸡蛋一边冒气泡一边沉到杯底;随着反应的进行,生成的二氧化碳气体附着在蛋壳表面上,浮力不断增大;当浮力大于重力时,鸡蛋慢慢上浮;当鸡蛋上浮到接近液面时,二氧化碳气体不断逸出进入空气中,使浮力小于重力,因此鸡蛋又下沉。如此不断循环反复,直至反应结束,鸡蛋沉入液面下。课后习题(2)馒头、面包等发面食品的一个特点是面团中有 许多小孔(如右图),它们使发面食品松软可口。根据发酵粉(含碳酸氢钠和有机酸等)可与面粉、水混合直接制作发面食品的事实,说明碳酸氢钠在其中的作用解:(2)NaHCO3和有机酸溶于水后,在蒸食品过程中生成CO2气体,使食品松软可口。2.通过一个阶段的化学学习,我们已经认识了许多物质,它们有的是单质,有的是氧化物,有的是酸、碱、盐。请用化学式各举几个例子。解答:开放性试题,举例如下:3.下列反应中不属于复分解反应的是( )A. H2SO4 + Ca(OH)2 = CaSO4 + 2H2OB. H2SO4 + BaCl2 = BaSO4↓ + 2HC1C. 2HC1 + Fe = FeCl2 + H2 ↑D. 2HC1 + CaCO3 = CaCl2 + CO2 ↑ +H2OC4.某同学发现,上个月做实验用的氢氧化钠溶液忘记了盖瓶盖。对于该溶液是否变质,同学们提出了如下假设:假设一:该溶液没有变质;假设二:该溶液部分变质;假设三:该溶液全部变质。请设计实验方案,分别验证以上假设,简要叙述实验步骤和现象,并写出相关反应的化学方程式。解:假设一:该溶液没有变质实验步骤:取少量该溶液于试管中,加入稀盐酸。实验现象:无气泡产生 化学方程式:NaOH+HCl==NaCl+H2O假设二:该溶液部分变质 实验步骤:取少量该溶液于试管中,加入过量氯化钙溶液,静置,取上层清液于另一支试管中,加入2~3滴酚酞溶液, 实验现象:有白色沉淀生成,上层清液变红 化学方程式:CaCl2+Na2CO3==2NaCl+CaCO3↓5.亚硝酸钠是一种工业用盐,它有毒、有咸味,外形与食盐相似。人若误食会引起 中毒,危害人体健康,甚至致人死亡。亚硝酸钠的水溶液呈碱性,食盐水溶液呈 中性。如果让你来鉴别亚硝酸钠和食盐,你选用什么试剂,如何操作?解:无色酚酞试液。操作:取少量盐溶于水中制成溶液,再加入2滴无色的酚酞,若溶液变红色,则原物质为亚硝酸钠;若溶液不变色,则原物质为食盐。6.氯化钠在生活、生产中的用途非常广泛。请通过查阅报纸、书刊、网络和访谈 等,了解氯化钠的用途,并以“氯化钠的妙用”为题编制资料卡片。解:氯化钠的妙用①医疗:生理盐水是0.9%的NaCl溶液;②农业生产:用氯化钠溶液选种;③生活:用食盐腌渍蔬菜、鱼、肉、蛋等;④交通:用氯化钠消除公路上的积雪;⑤化工生产:以NaCl为原料制取Na2CO3、NaOH、Cl2、盐酸等。
相关资料
更多










