


高中化学人教版 (2019)选择性必修1第三章 水溶液中的离子反应与平衡第一节 电离平衡教课ppt课件
展开知识点一 电离平衡常数
基础落实•必备知识全过关
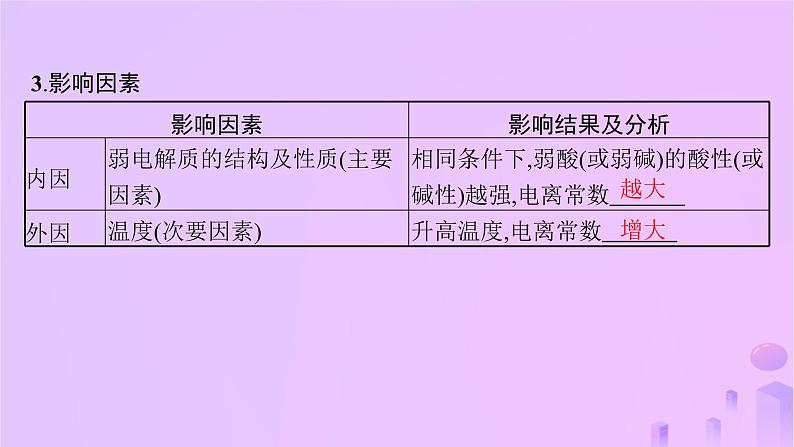
1.电离平衡常数的定义(1)对于一元弱酸或一元弱碱来说,溶液中弱电解质电离所生成的各种 的乘积,与溶液中 的浓度之比是一个常数,这个常数叫做电离平衡常数,简称电离常数。 (2)弱酸、弱碱的电离平衡常数通常分别用 表示。
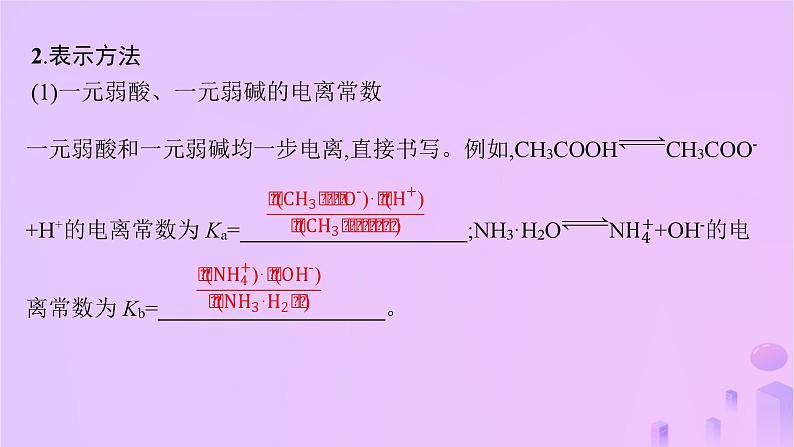
2.表示方法(1)一元弱酸、一元弱碱的电离常数
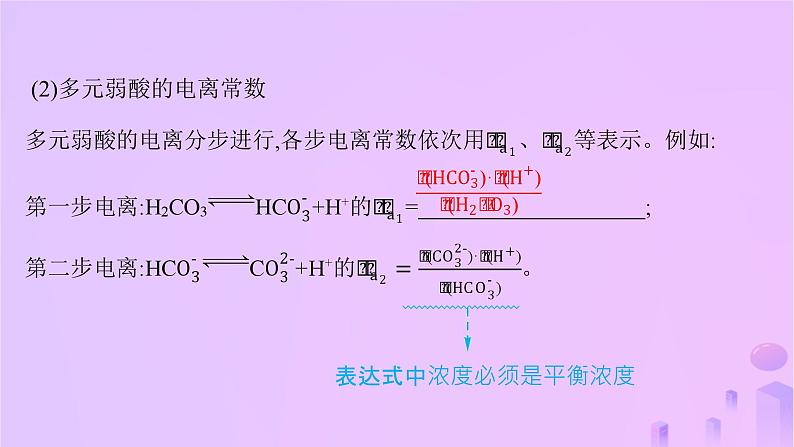
(2)多元弱酸的电离常数
表达式中浓度必须是平衡浓度
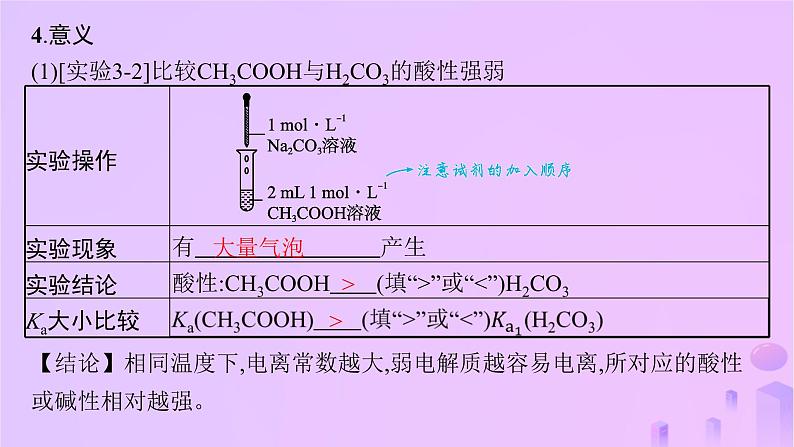
4.意义(1)[实验3-2]比较CH3COOH与H2CO3的酸性强弱
【结论】相同温度下,电离常数越大,弱电解质越容易电离,所对应的酸性或碱性相对越强。
(2)相同温度下,弱酸的酸性强弱与电离常数相对大小的关系可用下图表示:
名师点拨多元弱酸或弱碱的电离常数
教材拓展电离度(α)及计算(1)电离度可反映弱电解质的电离程度,当弱电解质达到电离平衡时,已电离的溶质分子占原有溶质分子总数的百分率称为电离度,通常用α表示。(2)计算表达式
α= ×100%,式中的分子、分母分别可用已电离的弱电解质的物质的量(或物质的量浓度)和弱电解质的起始物质的量(或物质的量浓度)来代替。
正误判断(1)弱电解质的电离平衡常数只与温度有关,与溶液的浓度等无关。( )(2)升高温度,醋酸的电离平衡正向移动,其电离程度和电离常数均增大。( )(3)25 ℃时,碳酸溶液加水稀释, 的值逐渐减小。( )
重难突破•能力素养全提升
探究角度1电离平衡常数及影响因素例1(2024·陕西西安期中)常温下,将0.1 ml·L-1 HNO2溶液加水稀释至0.01 ml·L-1的过程中,下列说法不正确的是( )
[对点训练1](2024·广东清远名校联考)已知25 ℃时,CH3COOH溶液中存在下述关系:Ka= =1.75×10-5,其中Ka的数值是该温度下CH3COOH的电离平衡常数。有关Ka的下列说法正确的是( )A.当向该溶液中加入一定量的硫酸时,Ka的值增大B.升高温度,Ka的值增大C.向CH3COOH溶液中加水,Ka的值增大D.向CH3COOH溶液中加氢氧化钠溶液,Ka的值增大
解析 向CH3COOH溶液中加入一定量硫酸时,c(H+)增大,CH3COOH的电离平衡逆向移动,但温度不变,Ka不变,A错误;CH3COOH的电离为吸热过程,升高温度,促进电离,Ka的值增大,B正确;向CH3COOH溶液中加水,促进CH3COOH的电离,但温度不变,Ka不变,C错误;向CH3COOH溶液中加氢氧化钠溶液,c(H+)减小,CH3COOH的电离平衡正向移动,但温度不变,Ka不变,D错误。
探究角度2一元强酸(碱)和一元弱酸(碱)的比较例2(2024·山东临沂期中联考)25 ℃时,等体积、c(H+)相同的盐酸和CH3COOH溶液分别加水稀释,溶液中c(H+)随溶液体积变化的曲线如图所示。下列有关说法错误的是( )A.曲线Ⅱ表示的是CH3COOH溶液的变化曲线B.a点对应溶液的导电能力比b点对应溶液的导电能力强C.a点对应酸的总浓度大于b点对应酸的总浓度D.等体积的a点、b点对应的溶液分别与锌粉反应,完全反应时消耗Zn的质量相同
解析 加水稀释,促进CH3COOH电离出H+,故稀释相同倍数时,CH3COOH溶液中c(H+)的变化比盐酸中c(H+)的变化小,即曲线Ⅰ表示盐酸的变化曲线,曲线Ⅱ表示CH3COOH溶液的变化曲线,A正确。溶液的导电能力与离子浓度有关,离子浓度:a点>b点,则导电能力:a点>b点,B正确。起始时c(H+)相同,CH3COOH部分电离,则起始时c(CH3COOH)>c(HCl),由于a、b点对应溶液的体积相同,故a点对应酸的总浓度大于b点对应酸的总浓度,C正确。起始时c(CH3COOH)>c(HCl),a、b点对应溶液的体积相同,则有n(CH3COOH)>n(HCl),故完全反应时a点溶液消耗Zn的质量大,D错误。
思维建模 相同c(H+)时,一元强酸(HX)溶液和一元弱酸(HY)溶液的比较
[对点训练2]相同体积、相同c(H+)的一元强酸溶液(①)和一元弱酸溶液(②)分别与足量的锌粉发生反应,下列关于产生氢气的体积(V)随时间(t)变化的示意图正确的是( )
解析 强酸完全电离,弱酸部分电离,则相同c(H+)的一元强酸溶液(①)和一元弱酸溶液(②)相比,酸的浓度:①<②。分别与足量锌粉发生反应时,弱酸的电离平衡正向移动,则反应开始后,相同时刻一元弱酸溶液中c(H+)大于一元强酸,则锌粉与一元弱酸的反应速率快;由于等体积时,一元弱酸的物质的量大于一元强酸,且锌粉足量,故最终一元弱酸中生成H2的体积大于一元强酸,只有C符合题意。
知识点二电离平衡常数的计算与应用
1.电离平衡常数的计算(1)利用“三段式”计算电离平衡常数以a ml·L-1 CH3COOH溶液为例,T ℃条件下,达到电离平衡时,c(H+)为b ml·L-1,则有CH3COOH H++CH3COO-起始浓度/(ml·L-1)a00变化浓度/(ml·L-1)bbb平衡浓度/(ml·L-1)a-bbb
(2)应用示例例如,25 ℃时,0.1 ml·L-1醋酸中,达到电离平衡时,c(H+)约为1×10-3 ml·L-1,则该温度下CH3COOH的电离常数Ka≈ 。
2.电离平衡常数的应用(1)比较酸性(或碱性)的相对强弱:相同温度下,等浓度弱酸(或弱碱)的电离常数越大,其酸性(或碱性)越强。(2)计算电离产生离子的浓度:根据电离平衡常数表达式,进行近似处理。(3)比较酸根结合质子(H+)的能力:相同条件下,酸性越弱,对应酸根结合质子(H+)的能力越强。例如,电离平衡常数:HNO2>CH3COOH>HCN,则结合质子(H+)能力:CN->CH3COO-> 。
误区警示误区:相同温度时,电离常数越大,酸性越强,溶液中c(H+)越大。分析:只有酸的浓度相同时,电离常数越大,酸性越强,溶液中c(H+)越大。
深度思考常温下,四种弱酸的电离常数如下表:
(1)四种酸的酸性由强到弱的顺序为 。 (2)四种离子:F-、CN-、CH3COO-、 结合质子能力由强到弱的顺序为 。 (3)向NaCN溶液中逐滴加入0.1 ml·L-1HF溶液,反应的离子方程式为 。
HF>HNO2>CH3COOH>HCN
HF+CN-===HCN+F-
探究角度1电离平衡常数的计算例1(2024·广东湛江模拟)已知25 ℃时,NH3·H2O的Kb=1.8×10-5。现有a、b两支试管,分别盛有10 mL浓度均为0.1 ml·L-1的氨水和盐酸,已知
A.a、b两试管中溶液的导电能力相同B.a试管中OH-的浓度约为1.34×10-2.5 ml·L-1C.将少量盐酸滴入a试管中,NH3·H2O的电离程度增大D.向a试管中加入10 mL 水,NH3·H2O的电离平衡逆向移动
解析 NH3·H2O为弱电解质,在溶液中部分电离,物质的量浓度相同时,a试管
错误;将少量盐酸滴入a试管中,盐酸电离出的H+和溶液中的OH-反应,使NH3·H2O的电离平衡正向移动,故NH3·H2O的电离程度增大,C正确;加水稀释,NH3·H2O的电离平衡正向移动,D错误。
【变式设问】向0.1 ml·L-1氨水中滴加少量NaOH溶液,NH3·H2O的电离平衡怎样移动?溶液中c(OH-)、Kb(NH3·H2O)将怎样变化?
提示 NH3·H2O的电离平衡逆向移动;溶液中c(OH-)增大,Kb(NH3·H2O)不变。
[对点训练1](2024·四川安宁河联盟联考)某温度下,在1 L 0.2 ml·L-1的氨水中存在:
B.该温度下NH3·H2O的电离常数Kb约为1.5×10-5C.加水稀释后电离平衡正向移动,c(OH-)增大D.与同浓度的NaOH溶液相比,氨水的导电能力更强
起始浓度/(ml·L-1)0.200变化浓度/(ml·L-1)1.7×10-31.7×10-31.7×10-3平衡浓度/(ml·L-1)0.198 31.7×10-31.7×10-3
则电离常数为Kb= ≈1.5×10-5,B正确;根据勒夏特列原理,加水稀释后电离平衡正向移动,c(OH-)减小,C错误;NH3·H2O是弱电解质,部分电离,与同浓度的NaOH溶液相比,氨水的导电能力更弱,D错误。
探究角度2电离平衡常数的应用例2(2024·北京通州区模拟)25 ℃时,已知三种酸的电离平衡常数,下列说法不正确的是( )
A.三种酸的酸性由强到弱的顺序是CH3COOH>H2CO3>HClOB.CO2与NaClO溶液反应生成HClO与Na2CO3C.25 ℃时,等浓度的三种酸溶液中c(H+):CH3COOH>H2CO3>HClOD.向NaClO溶液中滴加醋酸,可生成HClO,使杀菌、消毒能力增强
思维建模 从定性和定量角度分析电离平衡移动问题的方法(1)定性角度:利用勒夏特列原理分析电离平衡问题时,主要考虑稀释、改变温度、加入能电离出相同离子的盐等,平衡移动的结果只能“减弱”这种改变,但不能“消除”这种改变。(2)定量角度:当改变影响电离平衡的条件,分析两种微粒浓度之比时,若通过电离平衡移动的方向不能做出判断,要借助电离平衡常数进行定量分析。
[对点训练2](2024·河南TOP20名校联考)常温下,加水稀释H2C2O4溶液,下列物理量保持不变的是( )
学以致用·随堂检测全达标
题组1电离平衡常数及影响因素1.(2024·山西太原期中)25 ℃,稀释0.1 ml·L-1CH3COOH溶液,下图中横坐标表示加水的体积,则纵坐标Y可以表示( )A.Ka(CH3COOH)B.n(CH3COO-)C.c(CH3COOH)D.c(H+)
解析 稀释0.1 ml·L-1CH3COOH溶液,电离平衡正向移动,n(CH3COO-)增大,c(CH3COOH)、c(H+)均减小,B正确,C、D错误;由于温度不变,则电离常数Ka(CH3COOH)不变,A错误。
2.(2024·四川凉山州统考)已知常温下有关弱酸的电离平衡常数如下表:
下列推断正确的是( )
题组2电离平衡常数的计算与应用3.(2024·天津北辰区检测)25 ℃时,0.1 ml·L-1某一元酸HA的电离平衡常数约为1×10-7,下列叙述不正确的是( )A.该溶液中的c(H+)=1×10-4 ml·L-1B.此溶液中,HA约有0.1%发生电离C.0.1 ml·L-1HA溶液与c(H+)=1×10-4 ml·L-1的盐酸等体积混合,HA的电离平衡正向移动
4.(2024·广西柳州模拟)25 ℃时,CH3COOH、H2CO3和HClO的电离平衡常数如下:
(1)CH3COOH的电离平衡常数表达式Ka= 。 (2)25 ℃时,等物质的量浓度的HClO溶液和CH3COOH溶液中c(H+)关系为:HClO溶液 (填“>”“<”或“=”)CH3COOH溶液。
(3)下列化学反应能发生的是 (填字母)。 A.HClO+CH3COONa===CH3COOH+NaClOB.CH3COOH+Na2CO3===NaHCO3+CH3COONaC.CO2+H2O+2NaClO===Na2CO3+2HClO
高中化学人教版 (2019)选择性必修1第一节 电离平衡作业课件ppt: 这是一份高中化学人教版 (2019)选择性必修1<a href="/hx/tb_c4002426_t3/?tag_id=26" target="_blank">第一节 电离平衡作业课件ppt</a>,共33页。PPT课件主要包含了3×10-3等内容,欢迎下载使用。
高中化学人教版 (2019)选择性必修1第一节 电离平衡备课ppt课件: 这是一份高中化学人教版 (2019)选择性必修1第一节 电离平衡备课ppt课件,共22页。
高中化学人教版 (2019)选择性必修1第一节 电离平衡背景图ppt课件: 这是一份高中化学人教版 (2019)选择性必修1第一节 电离平衡背景图ppt课件,共17页。













